来源:BV1f4411n7x9 【陈巍学基因】视频37 p53基因与肿瘤
p53基因简介
- p53基因,又称TP53基因,其全称为Tumor Protein 53
- p53基因是防止正常细胞转变为癌细胞的,一个重要的看门基因;一个细胞的p53基因突变后,这个细胞发生癌变的可能性就大大增加了
- 50%以上的肿瘤病例当中有p53基因的突变或丢失
- p53基因位于第17号染色体的短臂上,编码一个有393个氨基酸残基的蛋白质
- 这个蛋白被称为p53,是因为其在电泳中,条带处于分子量Marker所标示的,53KD的位置,但是p53蛋白的分子量,实际上为43.7kD。
p53电泳速度被拖慢,是因为其含有大量的脯氨酸proline - p53蛋白刚翻译出来的时候,是以单体形式存在的,没有活性的;只有当4个单体聚合成一个同源四聚体后,才会获得活性
- p53蛋白总是把细胞向静止、修复、死亡的方向进行调控
p53基因和蛋白的结构与功能
p53蛋白的6个结构域

- 第1个结构域:第1个氨基酸残基-第43个,为第一个转录激活功能域transcriptional activation domain 1,TAD1
- 第2个结构域:第44个氨基酸残基-第63个,为第二个转录激活功能域TAD2
- 第3个结构域:第64个氨基酸残基-第92个,为富含脯氨酸的区域,称proline-rich domain,PRD
- 第4个结构域:第102个氨基酸残基-第292个,为DNA结合域,DNA-binding domain,DBD,与特定序列的DNA相识别,并且进行结合的功能域
- 第5个结构域:第320个氨基酸残基-第355个,负责将4个p53蛋白单体聚合成一个四聚体,称tetramerization domain
- 第6个结构域:第356个氨基酸残基-第393个,是羧基端的调控区,这一段包含了3个让p53蛋白定位到细胞核内的信号
p53蛋白在抑制癌症的发生发展中,起到的作用
- 不允许有DNA损伤的细胞进行分裂和增殖:在有DNA损伤时,p53可以把细胞停留在细胞周期的G1期,避免细胞进入S期
- 在DNA受到损伤时,p53会启动对DNA的修复功能
- 对于难以修复DNA损伤的细胞,p53就会将细胞老化senescence,即让这个细胞永远不能分裂
- 当DNA有严重的损伤时,p53会启动细胞的凋亡apoptosis,减少有DNA突变的细胞转变成癌细胞的可能性
p53基因受到的调控
对p53蛋白浓度的调控
MDM2蛋白对p53蛋白的调控
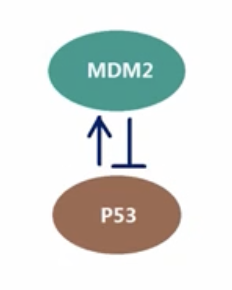
- MDM2蛋白是对p53蛋白进行调控的重要因素,其本质是一个泛素连接酶
- MDM2可以与p53结合,把泛素连接到p53上,激活蛋白酶体的蛋白降解途径
- p53蛋白会启动MDM2基因的转录:p53蛋白数量增加时,就会促进MDM2蛋白的生成,增多的MDM2蛋白降解p53蛋白
- p53蛋白,在通常情况下,半衰期在6分钟到20分钟之间,这时候p53蛋白会在细胞中,保持一个相对较低的浓度水平
DNA损伤对p53的调控
当细胞受到剧烈的DNA损伤时,ATM蛋白和ATR蛋白的数量开始增加,两者都会抑制MDM2,MDM2减少,p53蛋白的半衰期就相应地延长了
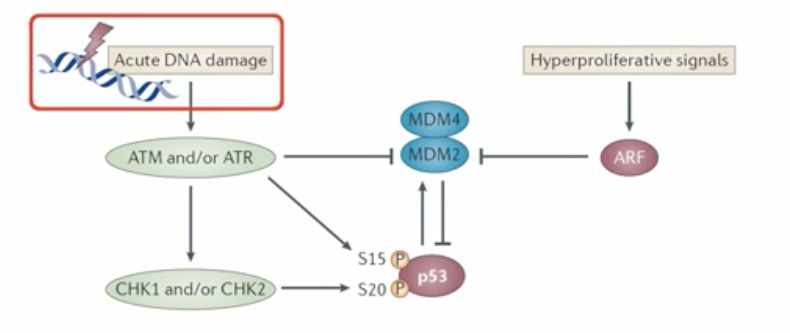
- ATM蛋白:ataxia telangiectasia-mutated gene,共济失调毛细血管扩张突变基因,是与DNA损伤检验有关的一个重要基因
- ATR蛋白:ataxia telangiectasia and Rad3-related,即“共济失调毛细血管扩张突变基因Rad3相关激酶,ATR激酶激活后可通过多种信号调控细胞生物过程, 包括细胞周期阻滞、抑制复制起点、促进脱氧核苷酸合成、启动复制叉以及修复DNA双链断裂)
细胞增殖信号对p53蛋白的调控
当有高的细胞增殖信号的时候,ARF蛋白的量会增加,ARF也能抑制MDM2,MDM2减少,p53蛋白的半衰期就相应地延长了
- 腺苷二磷酸核糖基化因子(ARF)家族属于小型GTPases的RAS超家族,通过调节膜运输和与细胞骨架的结合,参与多种生理过程,例如细胞增殖,运动和分化。像RAS超家族的其他成员一样,ARF家族蛋白被鸟嘌呤核苷酸交换因子(GEF)激活
对p53蛋白分子活性的调控
- ATM蛋白和/或ATR蛋白可以直接磷酸化p53蛋白
- ATM蛋白和/或ATR蛋白还可以增加CHK1和CHK2蛋白的的表达量,CHK1和CHK2也能磷酸化p53蛋白
- 被磷酸化的p53蛋白,与目标DNA的结合能力会大大增强;此外,被磷酸化的p53蛋白,与MDM2的亲和力会下降,即被泛素化降解的速度也会变慢
能够激活p53的外界因素
- DNA损伤
- 强增殖信号
- 氧化压力
- 缺氧
- 缺少营养
- 缺少核苷酸
- 复制压力
- 端粒损耗
- 这些因素都会增加细胞中p53的浓度,并且促进p53的磷酸化
p53基因对下游的调控
- 当p53的浓度升高,并且被磷酸化以后,p53蛋白就会开始对下游的调控了
- p53对下游基因的调控,主要是作为反式调控因子,作用于目标基因的顺式作用元件,增强部分基因的表达,也会减少另一部分基因的表达
这里介绍一些比较代表的基因,注意不是全部- 细胞周期捕获:将细胞阻止在G1期,防止细胞进入S期
- DNA修复
- 细胞老化
- 细胞凋亡
- 代谢和抗氧化:p53的调控方向是减弱细胞的合成代谢
- 细胞自噬:加强细胞自噬
- 肿瘤微环境:加强周围的免疫反应和炎症反应,吸引更多的巨噬细胞和免疫细胞,“向我开炮”
- 细胞的侵袭和转移能力:减弱细胞的侵袭和转移能力
- 干细胞功能:阻止干细胞功能(干细胞和肿瘤细胞有很多相似性,它们都有很强的增殖能力,分化程度都很低,肿瘤细胞就像体细胞发生了逆分化,向干细胞进行倒退的结果)
p53基因在肿瘤中的突变
- 肿瘤当中p53基因的突变,75%是错义突变,错义突变的空间位置主要集中在p53蛋白与目标DNA结合的结构域中,我们还能发现这些突变中,有6个氨基酸残基的突变频率特别高
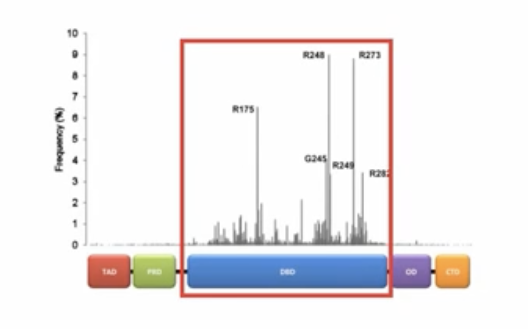
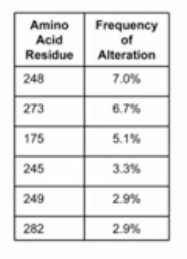
- 有研究表明,突变的p53基因的表达产物,mutant-p53蛋白,不仅会丧失抑制肿瘤生长的功能,还会在一定程度上促进肿瘤的生长,可能的机理如下:
- p53蛋白要变成4聚体才能发挥作用,而mutant-p53蛋白与wild-type-p53(以下写作wt-p53)蛋白结合后,让整个四聚体都失去了抑癌活性,即“一颗老鼠屎坏了一锅粥”
- p53蛋白的氨基酸序列改变之后,会结合到原本不应该结合的基因上,启动/抑制了原本不该被调控的基因,这可能在一定程度上抑制肿瘤的发生
- 有研究表明,突变的p53基因的表达产物,mutant-p53蛋白,不仅会丧失抑制肿瘤生长的功能,还会在一定程度上促进肿瘤的生长,可能的机理如下:
针对p53基因失活的药物的研发情况
- 在目前为止,还没有任何一个针对mutant-p53的靶向药物上市
为什么研发p53基因的药物如此困难
- EGFR和ALK基因都是激酶,它们的突变引起的癌症,都是因为细胞对它们的激酶活性失去了控制,失控的激酶活性变得很强
- 一个奇特的比喻:抢劫犯(肿瘤驱动基因)冲进小区进行抢劫(细胞异常增殖),那么我们对付这种抢劫犯,最直接的办法就是瞄准(基因伴随诊断找到驱动基因),开枪(靶向药物治疗);只要把抢劫犯打倒(用药物抑制住肿瘤驱动基因),小区就安全了
- p53是不一样的:p53是一个小区保安,保安在健康的时候,可以防止坏人进来你,mutant-p53相当于小区保安突然死亡,导致小区的大门无人值守,坏人冲进来抢东西(发生肿瘤);想要把一个倒地不起的保安(突变失活的p53)救起来,再请复活的保安把坏人赶出小区的难度,肯定要大于直接对着抢劫犯开枪
现有的进展
- 能够与mutant-p53蛋白结合的两种化合物
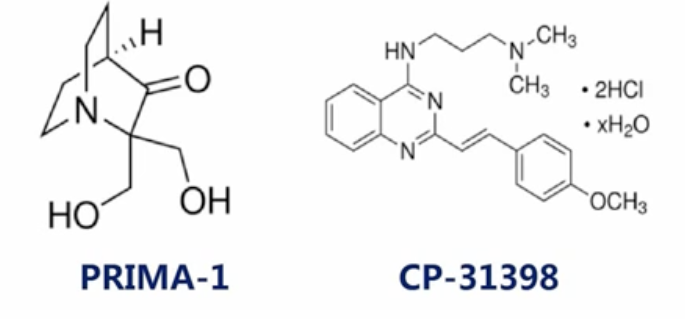
- 这两种化合物能在一定程度上恢复mutant-p53蛋白与DNA结合的能力,并且能够增强其引导细胞凋亡的能力
- 这两个化合物,距离成为正式的上市药物,还非常地遥远
p53基因的数量改变及其影响
少一个p53基因
- 一个人的基因组中天生少一个wt-p53基因的疾病:Li-Fraumeni综合症;患者得癌症的概率远远高于普通人,50%的患者在30岁前得癌症,90%的患者会在70岁前得癌症
多一个或几个p53基因
- 得癌症的概率会,但我们很可能不愿意承担对应的代价
- 能够实现这一点就很有挑战,转基因或胚胎修饰在伦理上不能过关
- 增加p53基因的拷贝,很可能会让人提前衰老,因为p53基因总是倾向于让细胞不分裂和不增殖,这时组织和器官就得不到足够的、新的细胞的补充了,人就很容易显得衰老
- 自然界有多个p53基因拷贝的动物:大象
- 大象的体重是7-8吨,我们可以说一个大象的体重相当于100个成年人的体重,也就是大象身上的体细胞的数量,是人的提细胞数量的100倍
- 如果大象的每个细胞的癌变几率,与人类细胞的几率是一样的,那么大象得癌症的概率就是人类的100倍了
- 科学家解剖了一些死亡的大象后发现,大象因为癌症死亡的比例大约是3%,而在人类中,这个比例超过了10%,即大象得癌症的机率比人类低,平均到每个细胞,大象的每个细胞发展为癌下波的机率就比人类细胞低很多了
- 研究发现大象有20个p53基因,即每个细胞里有40个p53基因的拷贝
- 可以说:大象是用p53基因拷贝数量的冗余,来保证低的细胞癌变风险



