- 主要包括药物+通路和药物+分子两种类型
- 主要论证的过程:
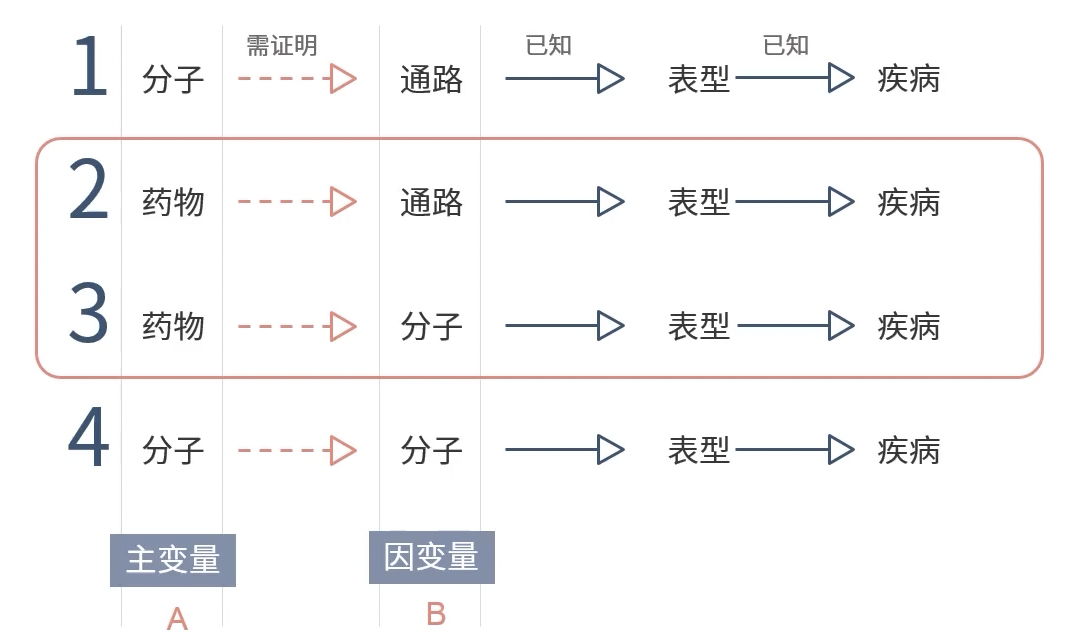
- 药物调表型
- 药物调节通路/分子
- 药物调节表型靠通路/分子(回复实验)
- 复习三十六策 Lesson 5的内容,以药物为研究对象的课题只负责回答两个问题,四种类型
- 药物为什么有效?-发现新药/老药新用
- 药物为什么无效?-耐药机制/耐药逆转
- 与分子作为主变量相比,药物作为主变量没有多种多样的变化类型,也不需要制备复杂的操作工具,比研究分子高效不少。
使用的文献:

- IF在3-5分左右,可见药物+分子/通路都可以产生具有机制内容的课题了,在药物或者机制上抓住创新点,跨过3分是可行的
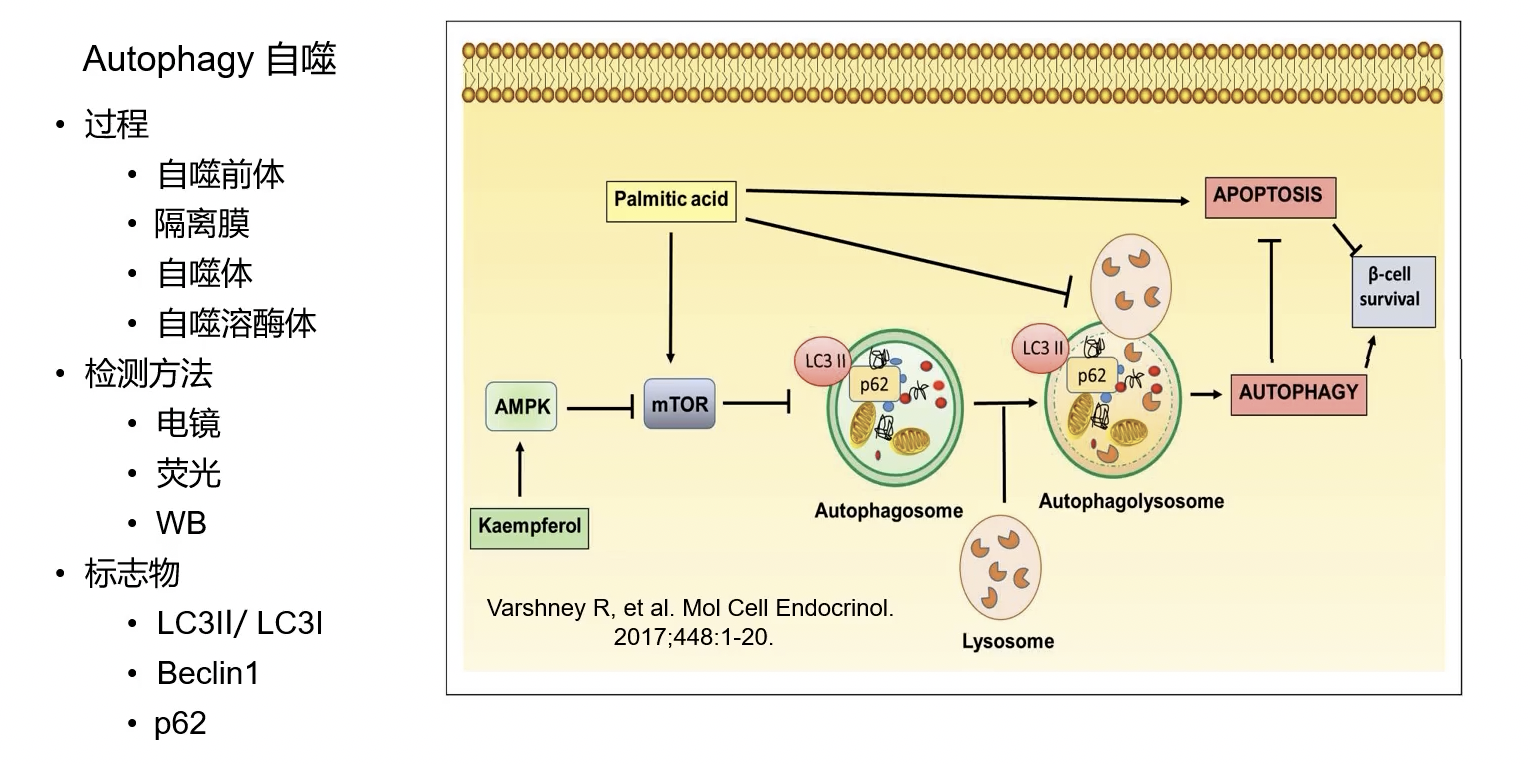
补充知识:自噬表型
- 复习:二十四型 Lesson 5
- 简单po一张图:
复习:文献泛读四步骤
文献1
读题目

论证套路
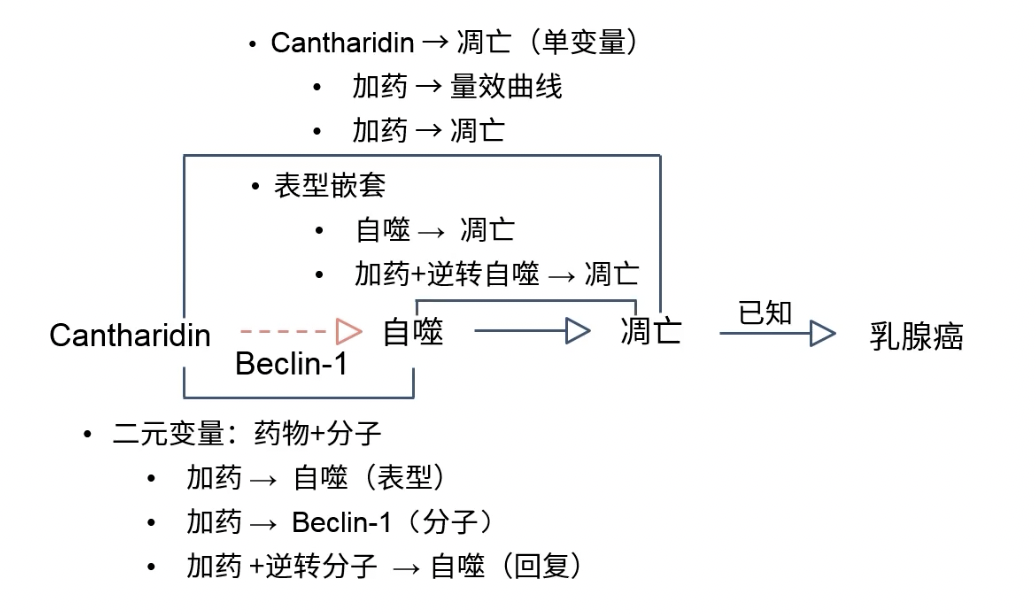
单变量1:药物与表型的关系
- 药物研究和我们常做的功能基因研究不一样,它没有基础表达和正反回复环节的设计,对于这篇文章来说,首先要摸索药物有效浓度,然后在加药时观察细胞死亡的情况
二元变量:药物通过通路诱导表型,“三部曲”
- 加药观察自噬表型
- 加药观察通路变化
- rescue回复实验:先加药,观察通路和自噬变化,再加药的同时逆转通路,再观察表型
单变量2:自噬与细胞死亡的单变量
- 操作自噬,观察细胞死亡
- (可选):设计rescue实验,加药的同时逆转自噬,观察表型
Fig.1
- 两张图,横坐标是药物的梯度浓度,纵坐标是细胞活性和BrdU染色实验,典型的增殖表型
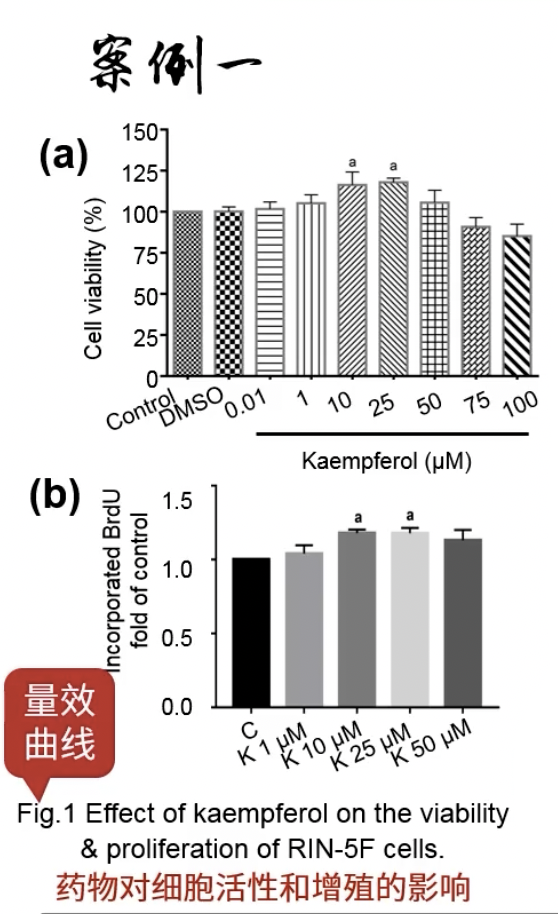
- 药物K能够上调细胞活性,尤其是在10和25这两个浓度的条件下
Fig.2
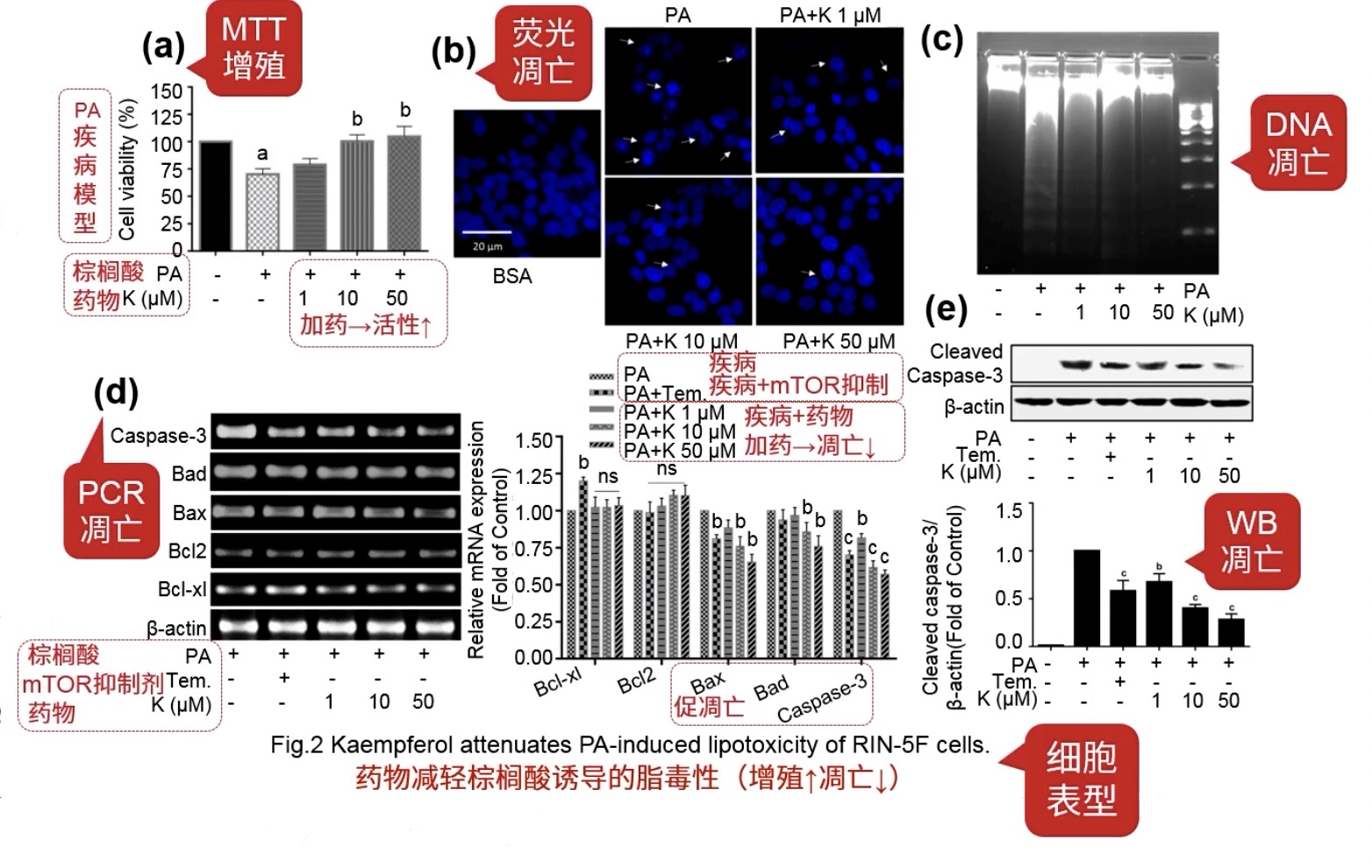
- 药物减轻了棕榈酸诱导的脂毒性,棕榈酸是胰岛β细胞死亡模型所运用到的药物
- Fig.2a:增殖表型,证明加药后细胞活性增强
- Fig.2b-e用到了各种方法检测细胞凋亡的表型,注意Fig.2分组发生了变化,出现了Tem,这个物质是mTOR的抑制剂,可以看作自噬的激活剂
- 注意Fig.2d的分组:PA-疾病组;PA+Tem:疾病+促进凋亡;PA+K:疾病模型下的加药组,可以看到加药之后,一堆促凋亡蛋白表达都下调了,说明加药能够抑制凋亡。
Fig.3
- 自噬的细胞表型
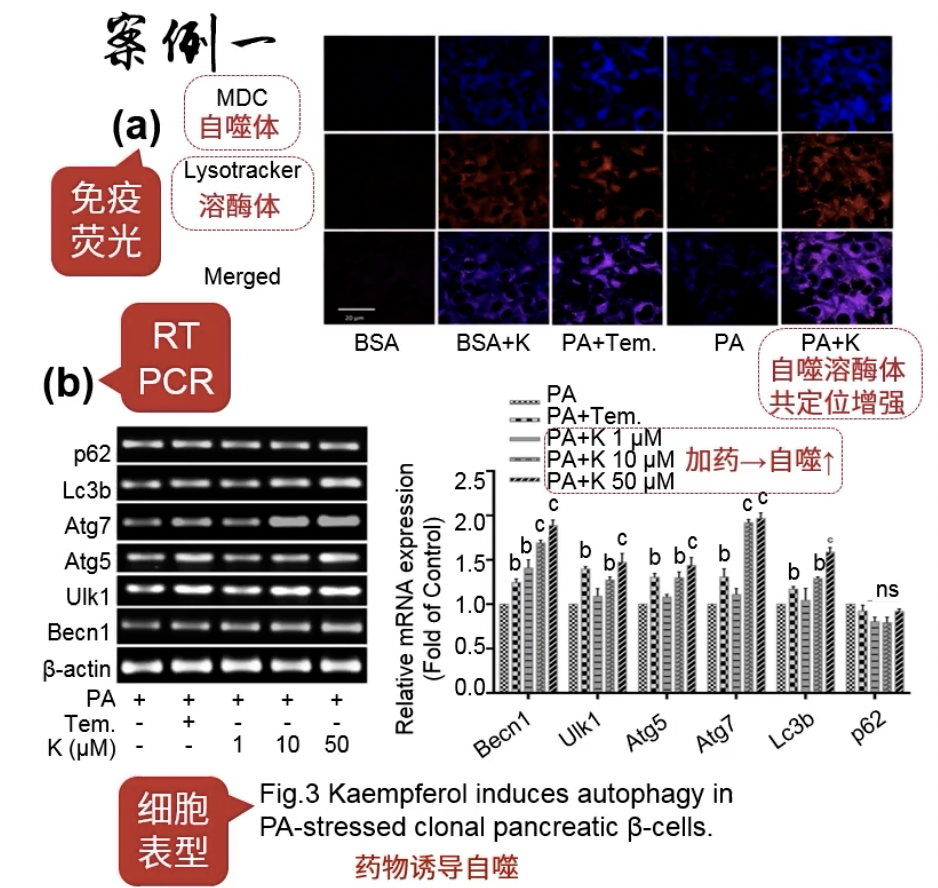
- Fig.3a:免疫荧光观察自噬体的荧光,荧光共定位越多说明自噬越强
- Fig.3b:PCR检测加药后的自噬,发现加药后自噬增加
Fig.4
- 自噬的细胞表型
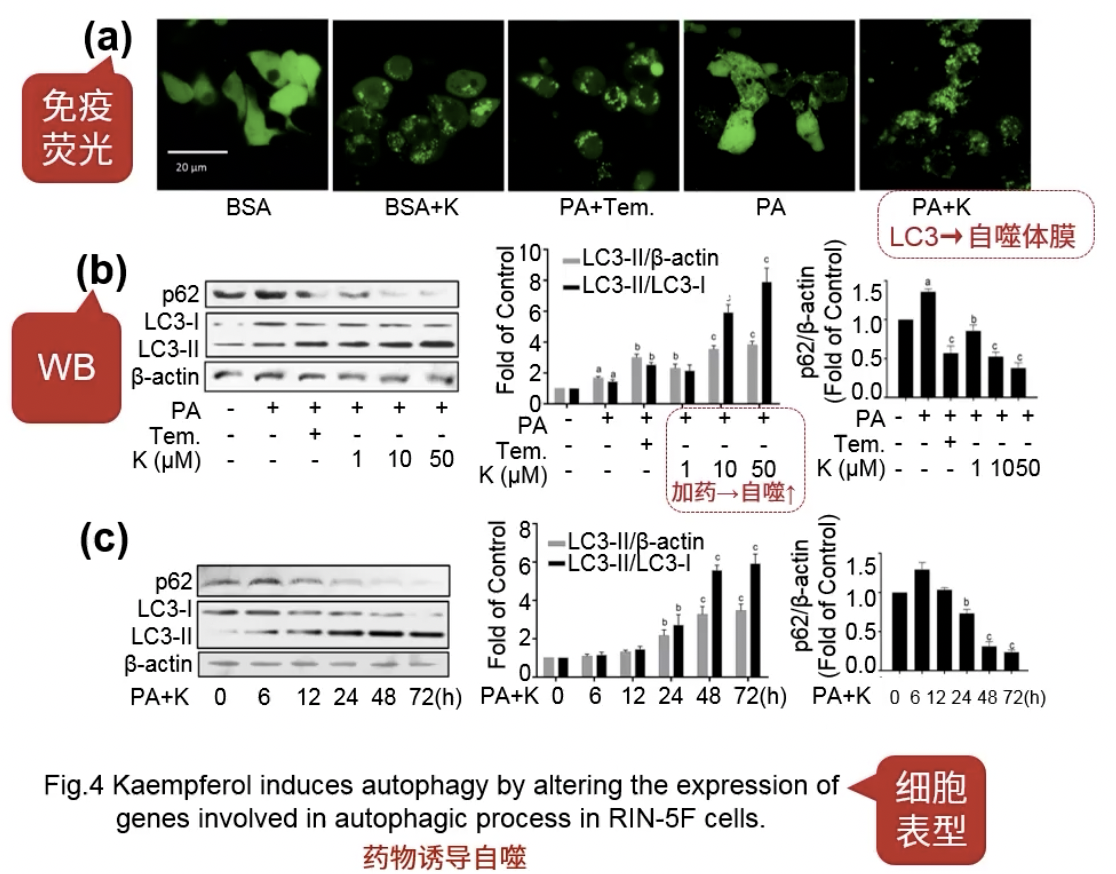
- Fig.4a:免疫荧光检测LC3,自噬过程中LC3会发生聚集,从胞浆转位到胞膜,在荧光显微镜下会形成明亮的绿色荧光斑点
- Fig.4b:Western检测自噬相关的蛋白情况,说明了加药能够激活自噬
Fig.5
- 加自噬抑制剂,做rescue
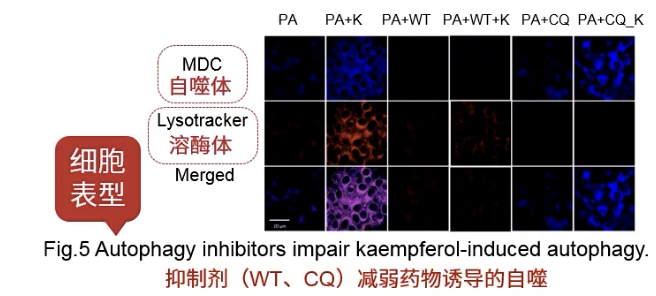
- 荧光观察自噬体的结构
Fig.6
- 加自噬抑制剂,做rescue
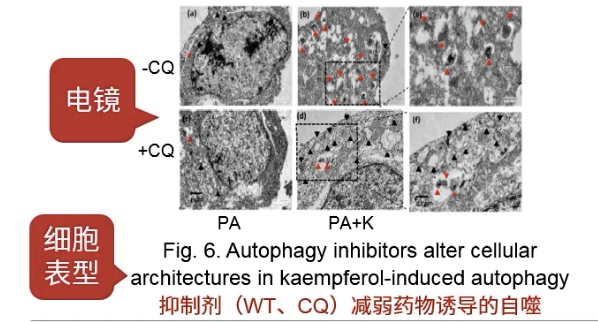
- 电镜观察自噬体的结构
Fig.7
- 加自噬抑制剂,做rescue
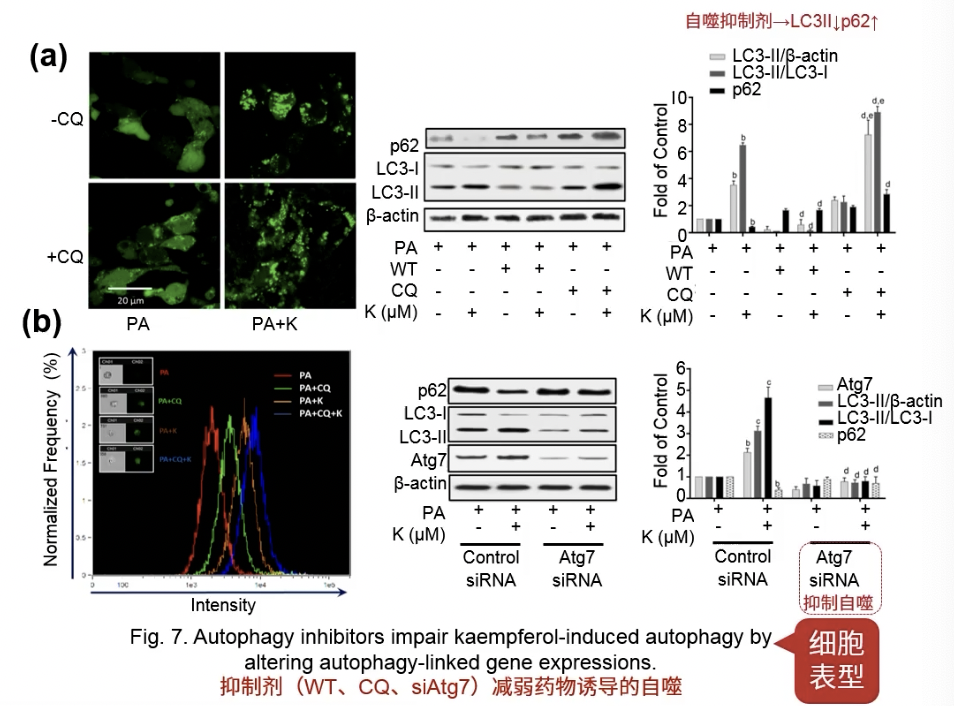
Fig.8
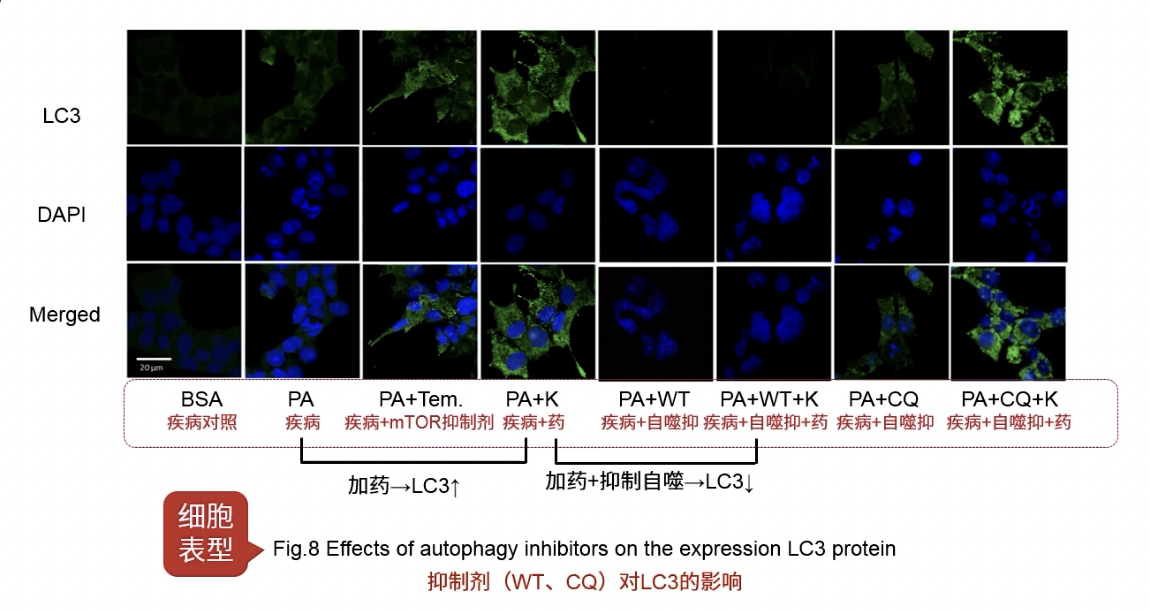
- 观察PA和PA+K,加入研究药物K后观察到LC3转位到细胞膜,激活了自噬
- 观察PA+K和PA+WT+K,可以发现加入自噬抑制剂后,自噬减弱了
Fig.9
- 间接机制,药物通过AMPK/mTOR通路介导自噬
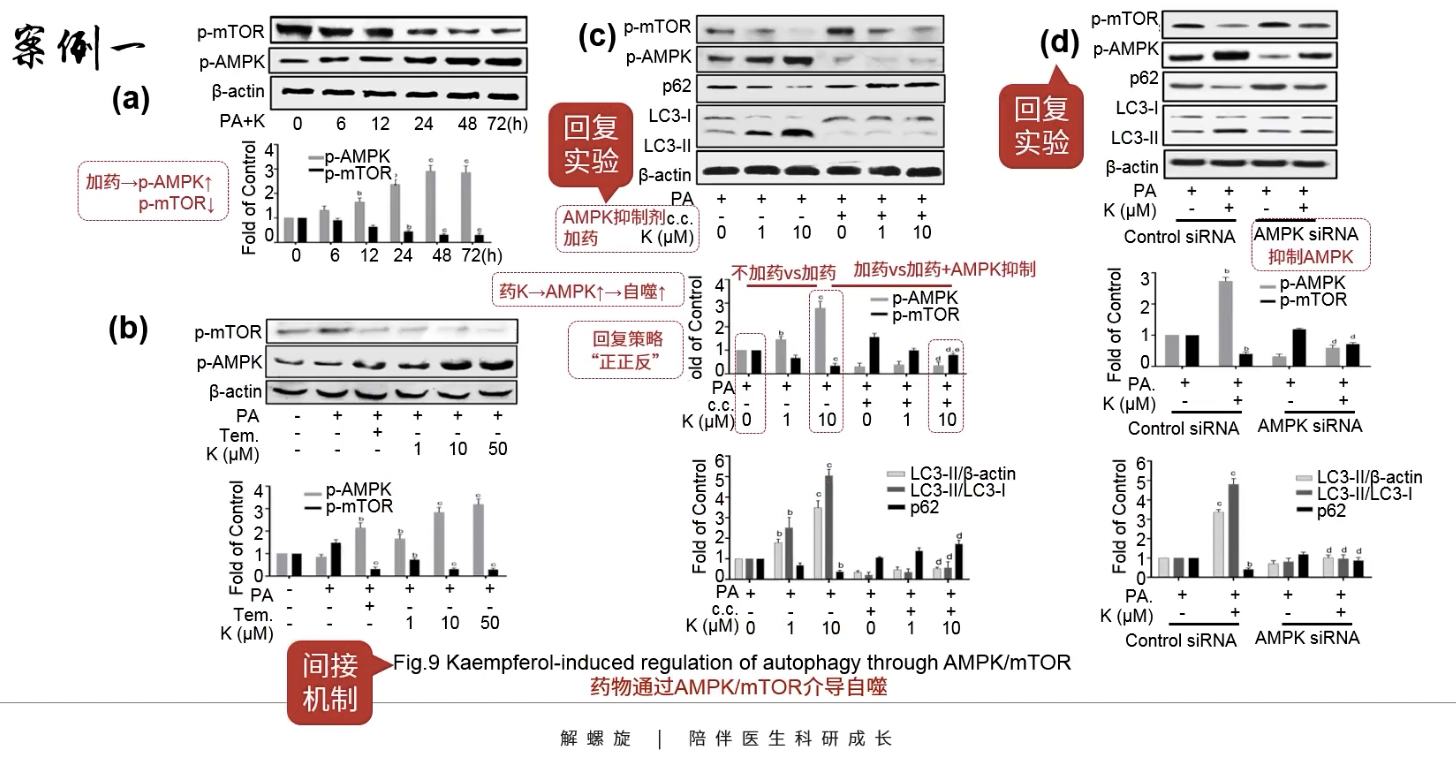
- 引出了通路,间接机制的研究
- AMPK是mTOR通路的抑制性分子,在细胞能量不足时被激活(AMP dependent kinase),可以拮抗mTOR分子的活性
- 在Fig.9a和b当中,加药可以导致p-AMPK表达升高,p-mTOR表达降低
- Fig.9c在加药的同时引入了AMPK抑制剂c.c.,观察自噬相关标志物,这就是rescue了,由于药物本身上调AMPK信号通路,激活自噬,所以回复策略是“正正反”
- Fig.9d引入了AMPK的siRNA,这又是一个rescue实验
- 一个阅读本图中各种复杂柱状图的策略:(以Fig.9c为例)
- 首先观察左边的PA+c.c.-K0(理解为什么都不加的对照组)和PA+c.c.-K10(只加了药),观察到p-AMPK表达升高,p-mTOR表达降低,以及自噬标志物LC3-Ⅱ表达升高,提示自噬发生增加
- 接着观察Pa+c.c.-K10(只加了药)和最右边的PA+c.c.+K10(又加药又加抑制剂),观察到自噬标志物LC3-Ⅱ表达减少,提示自噬发生减少
Fig.10
- 加入AMPK抑制剂,用免疫荧光观察表型,还是rescue的思路。
- 观察了自噬体结构以及LC3的表达情况
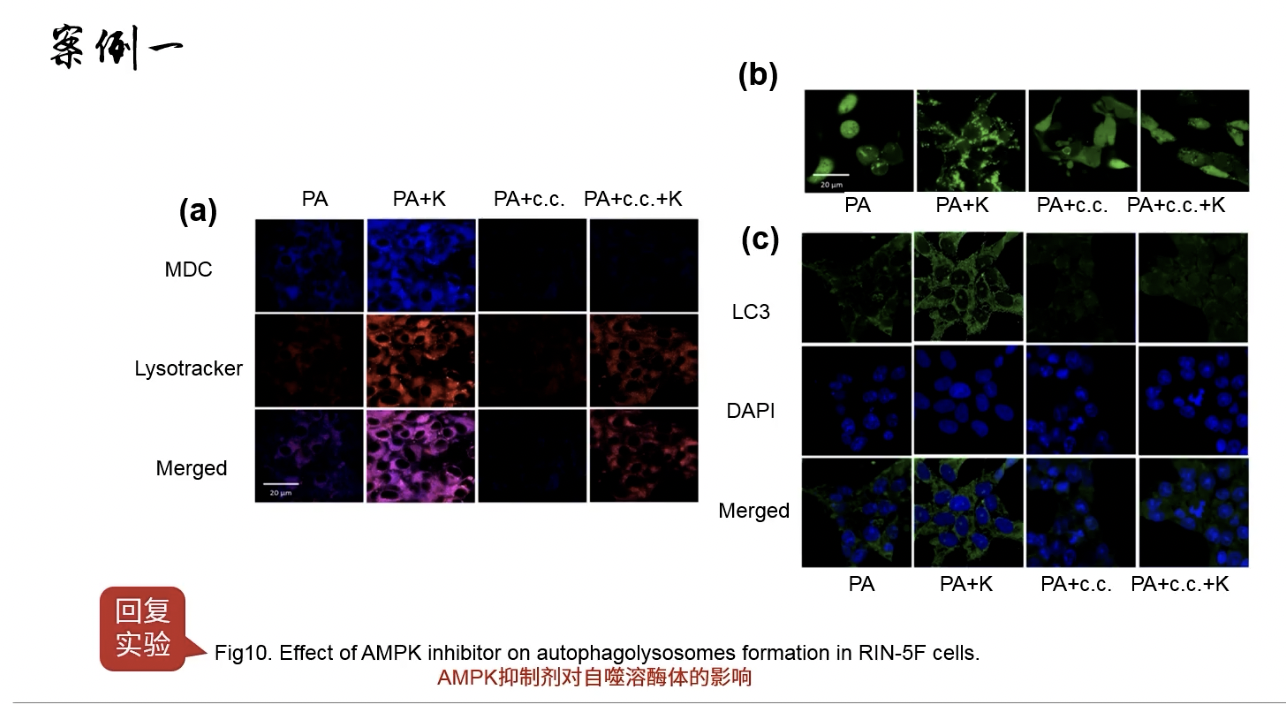
Fig.11
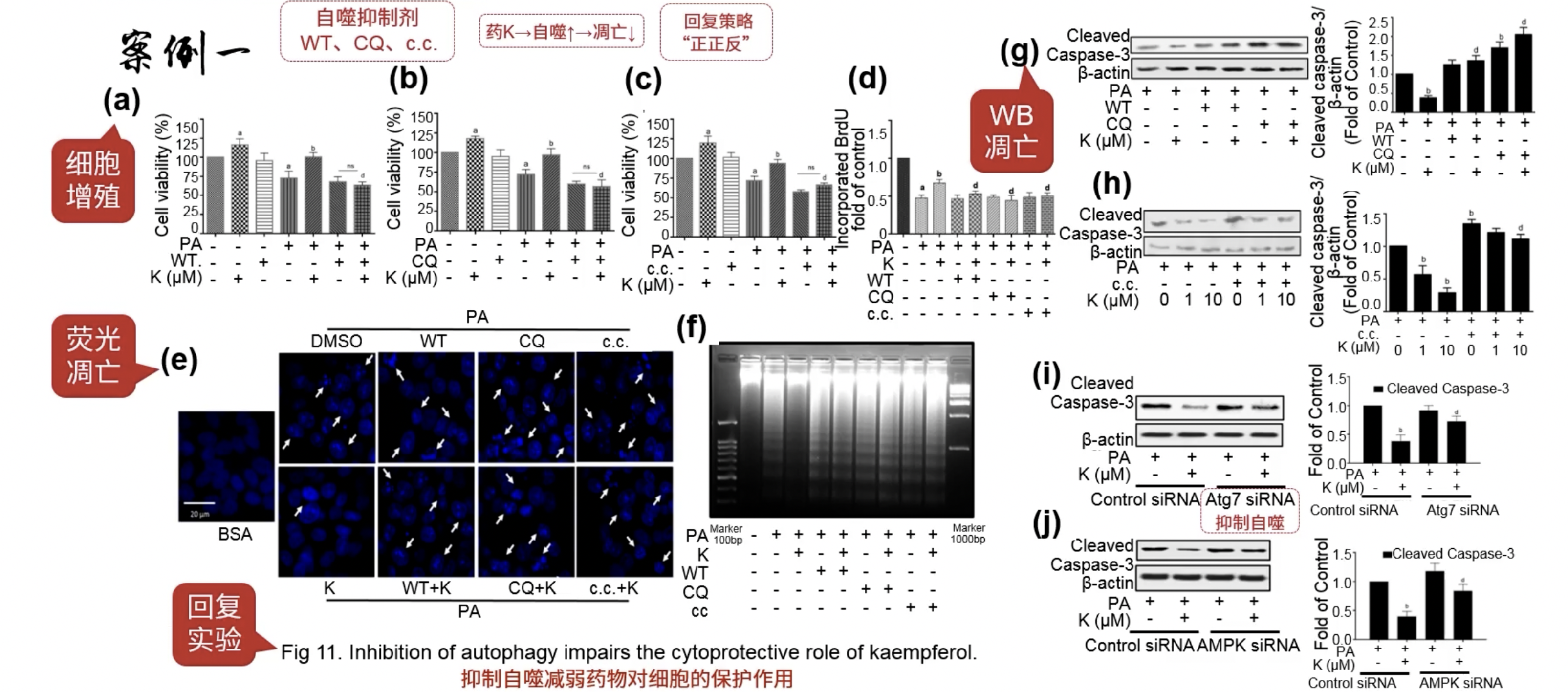
- 抑制自噬,观察药物对细胞的保护作用是否存在,rescue又来了,不过和前面的rescue设计思路并不相同,这里论证的是药物通过激活自噬,减少凋亡的过程
- 作者加了各种自噬抑制剂WT、CQ、c.c.,以及siATG7,观察增殖和凋亡表型,由于药物和药物和自噬是正调节的关系,所以回复策略还是“正正反”
Fig.12
- 做了原代细胞的培养,验证前面细胞系的结果
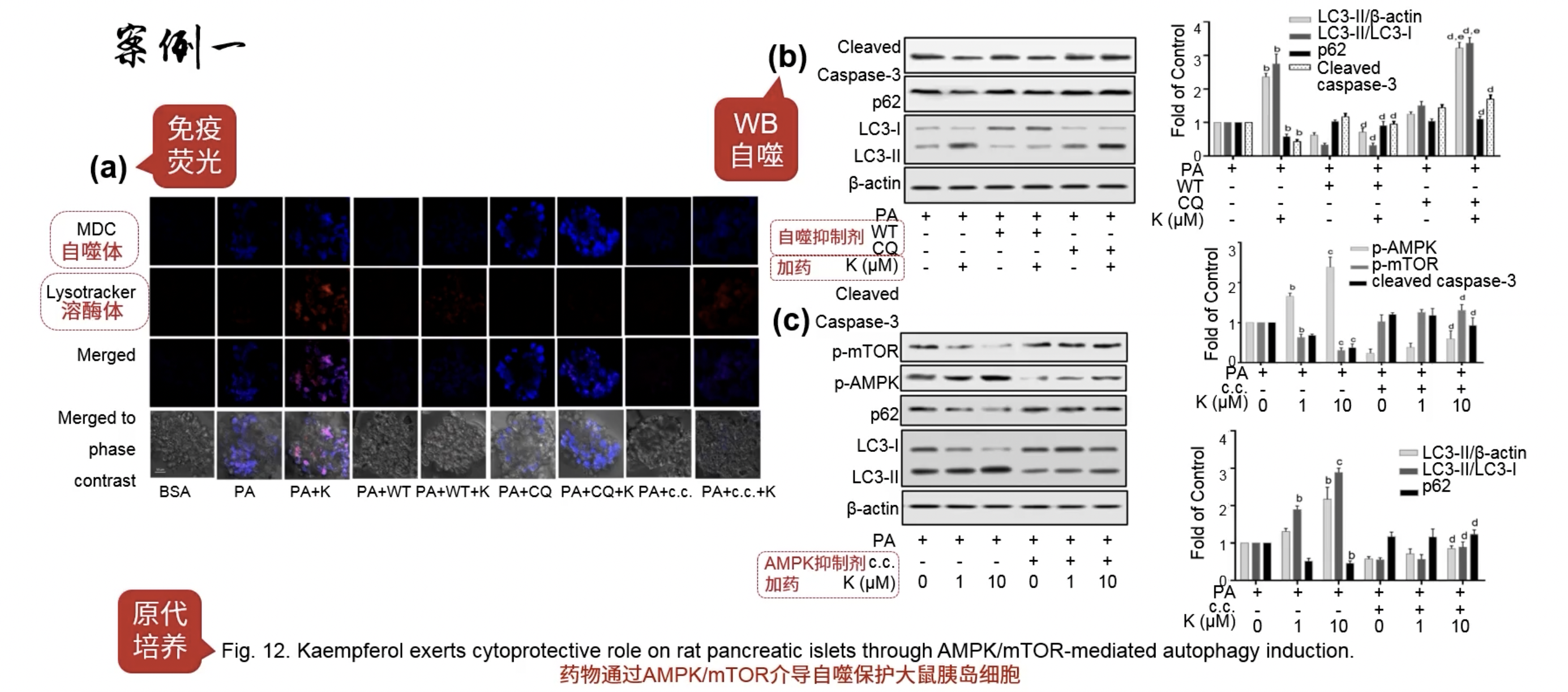
- 也设计了两个rescue实验,分别是加药抑制自噬观察凋亡 ,加药的同时抑制AMPK观察自噬
- 总而言之,这张图证明了药物通过AMPK介导自噬,保护大鼠的胰岛细胞
小结
- 作者主要论证的是药物+通路的二元变量结构,其中有表型的因果嵌套
- 药物通过激活AMPK抑制自噬,最终减少胰岛β细胞的凋亡
- 文章主要的创新点在药物上,通过找到了药物下游的通路,回答了药物为什么有效的问题
- 论证关系如下图所示
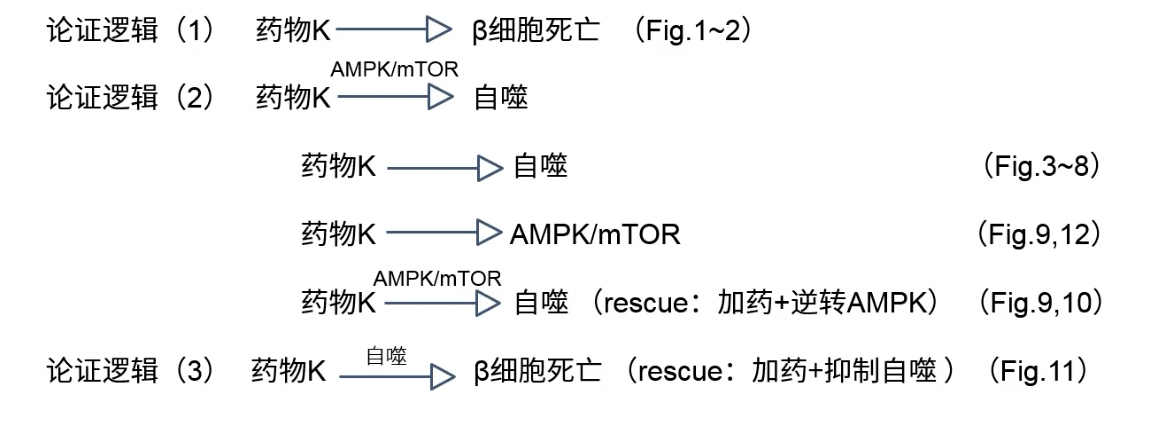
- 在数据维度方面,文章缺少组织和动物水平的数据
文献2
- 自噬和凋亡经常出现因果嵌套,绑定出现在文章之中。

- 题目中的in vitro和in vivo提示了有细胞和动物水平的数据
论证套路
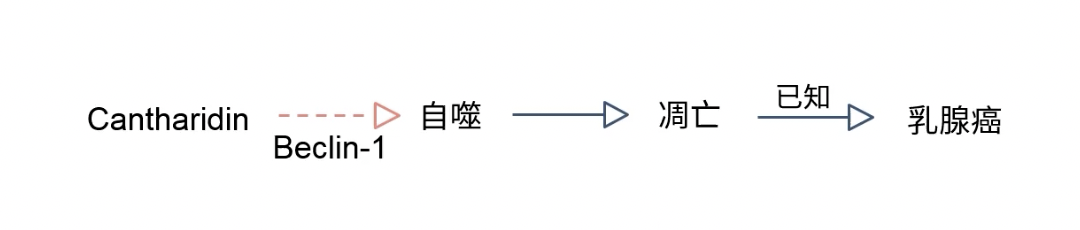
单变量:药物和凋亡
二元变量:药物通过Beclin-1介导自噬
单变量:自噬与凋亡
Fig.1
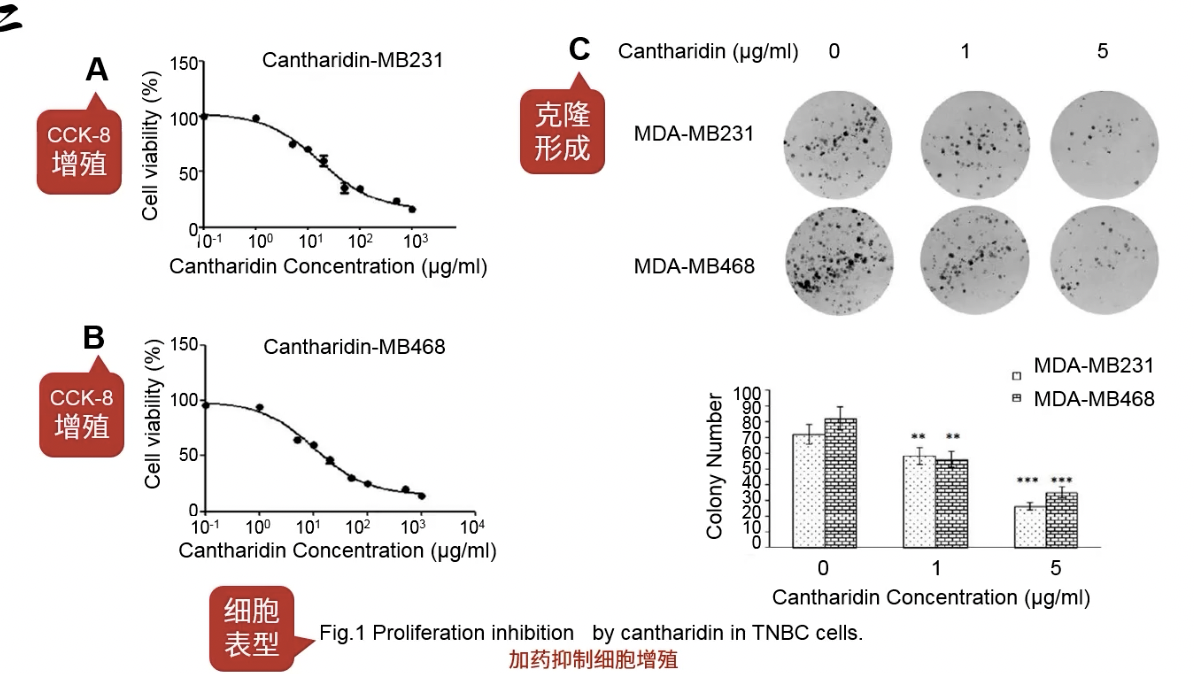
- 加药抑制细胞增殖
- Fig.1a-b,横坐标是药物浓度,纵坐标是细胞活性,这是在两个乳腺癌细胞系上,用CCK-8检测细胞活性的结果
- Fig.1c是克隆形成实验的结果
Fig.2
- 检测凋亡的细胞表型
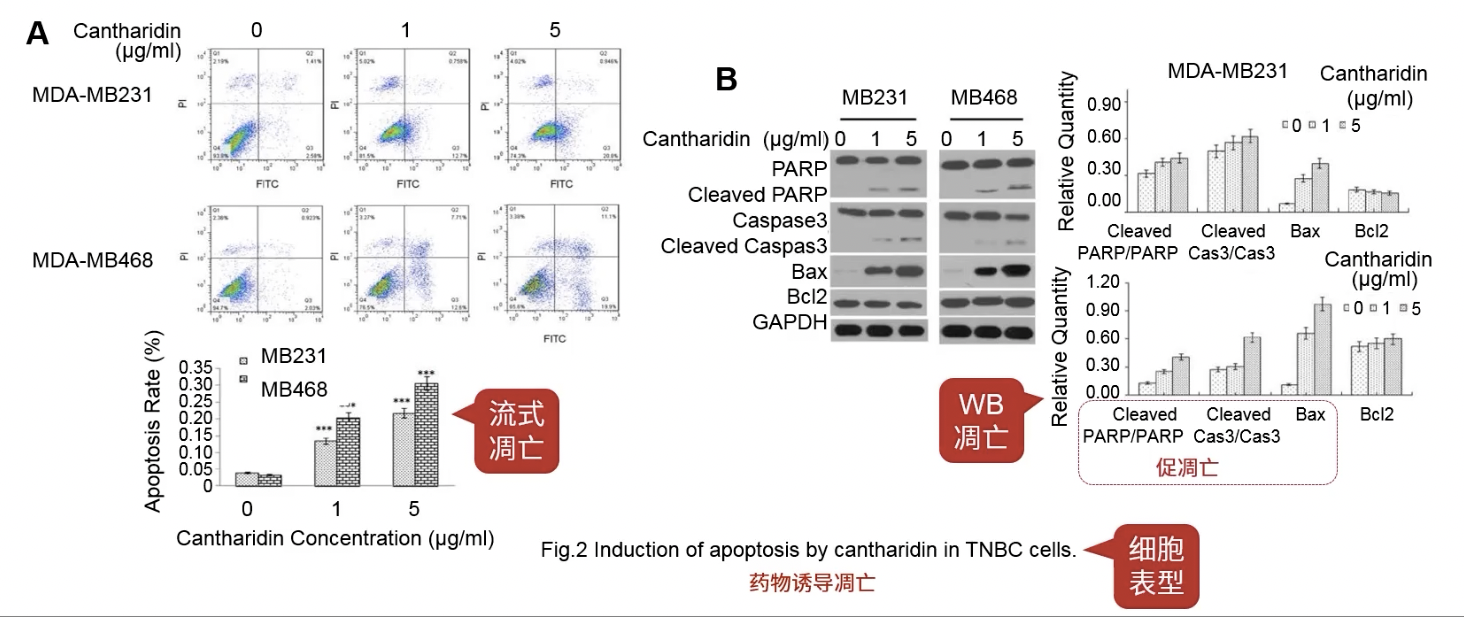
- Fig.2a是流式细胞学的结果,随着药物浓度的升高,细胞凋亡显著增加
- Fig.2b检测了几种与细胞凋亡相关的marker,其中以Cleaved PARP为代表的促凋亡蛋白在加药之后增加了
- 总之,流式和凋亡的结果都支持加药诱导凋亡的论点
Fig.3
- 加药抑制自噬
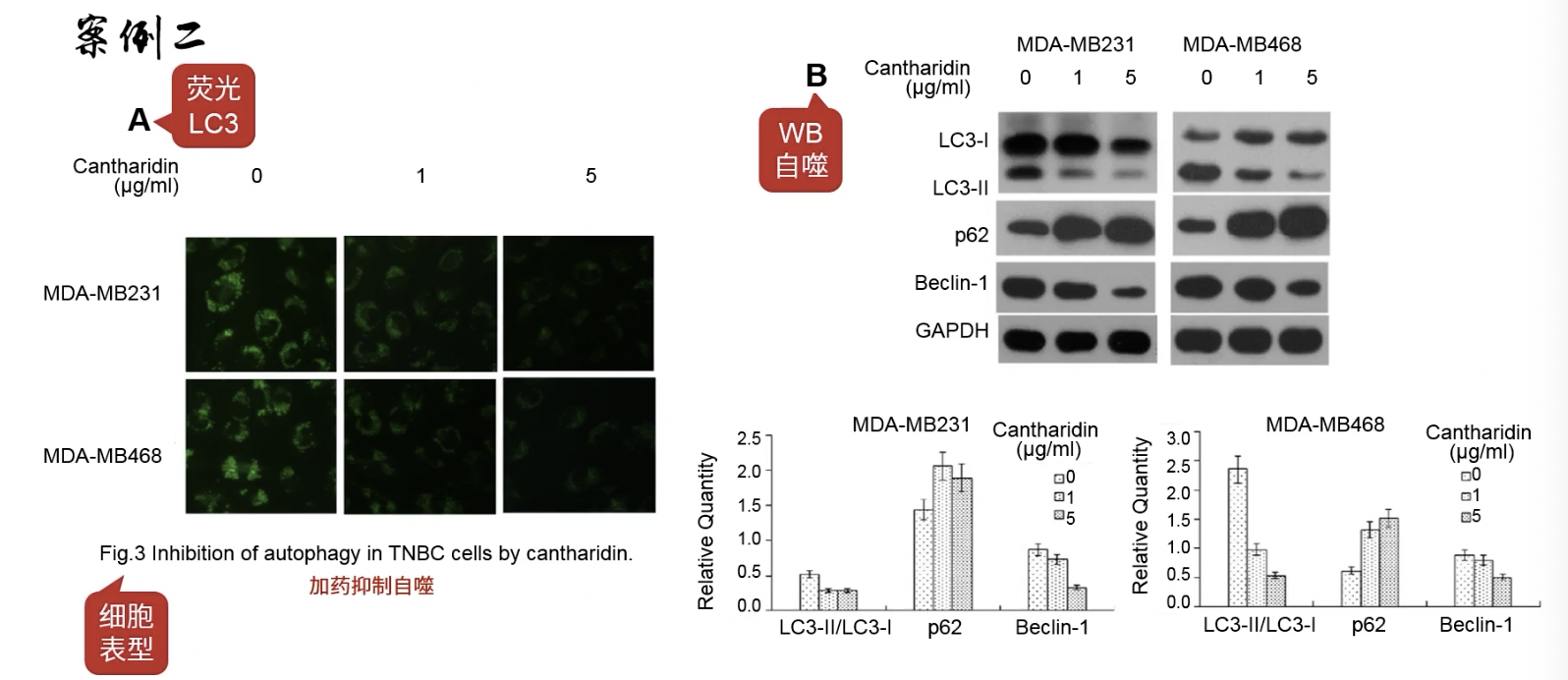
- Fig.3a用免疫荧光检测明星分子LC3的表达情况
- Fig.3b用WB检测自噬相关biomarker,随着药物浓度增加,Beclin-1的浓度显著降低,说明加药抑制了自噬的发生
Fig.4
- 药物依赖自噬介导凋亡——rescue实验,考虑到自噬和凋亡的上下游调控关系是相反的,这里采用“反正正”的策略
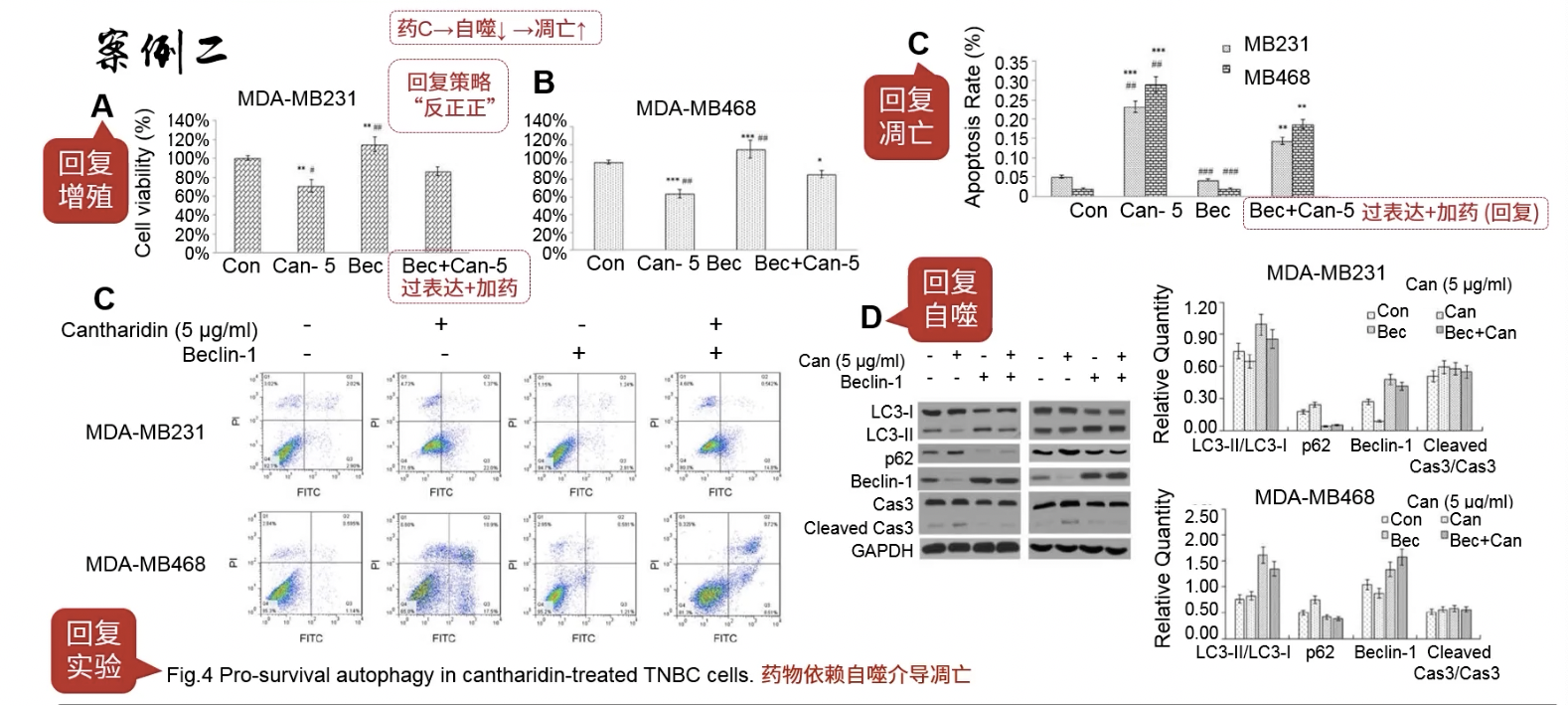
- Fig.4a和4b是细胞增殖实验的结果,Bec+Can-5是加药的同时过表达Beclin-1
- Fig.4c和4d也是rescue,同时操作药物和下游分子,观察自噬和凋亡的表型
Fig.5
- 动物实验的结果
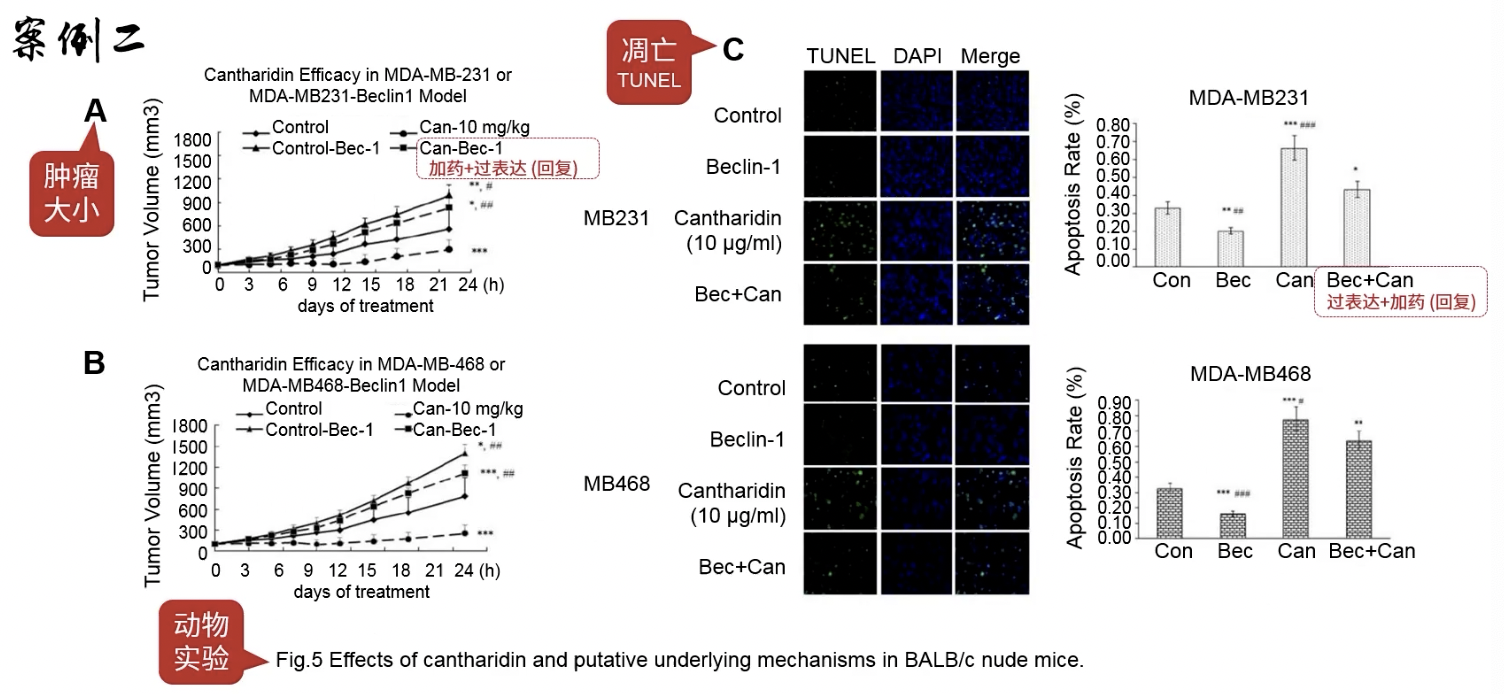
- 部份实验组同时操作了药物和下游分子,观察肿瘤体的大小和凋亡表型,进一步论证药物通过自噬影响凋亡的结果
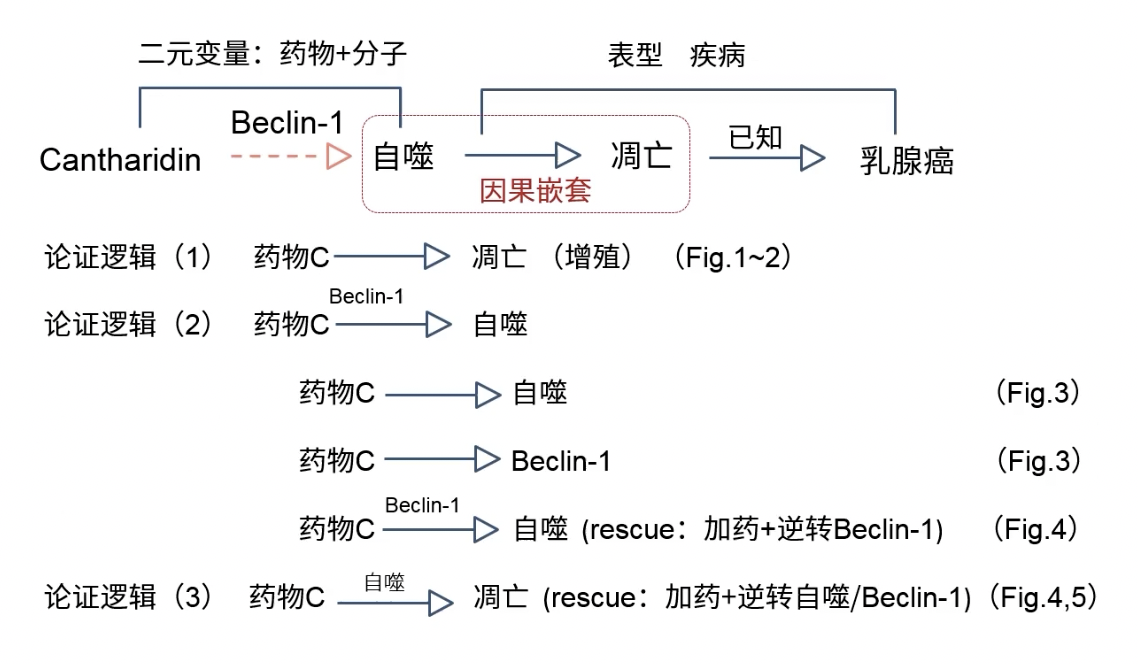
总结
- 作者主要论证的是药物+分子的二元变量结果,其中还有表型的因果嵌套
- 文章的论证逻辑如下,和上一篇文章基本是一致的
文献3
论证套路


Fig.1
- 一张图,给了药物的分子结构,分子式、分子量
- 一般来说新药/新提取出的有效成份,都得这么来一通
Fig.2
- 药物与表型(关节炎)之间的关系
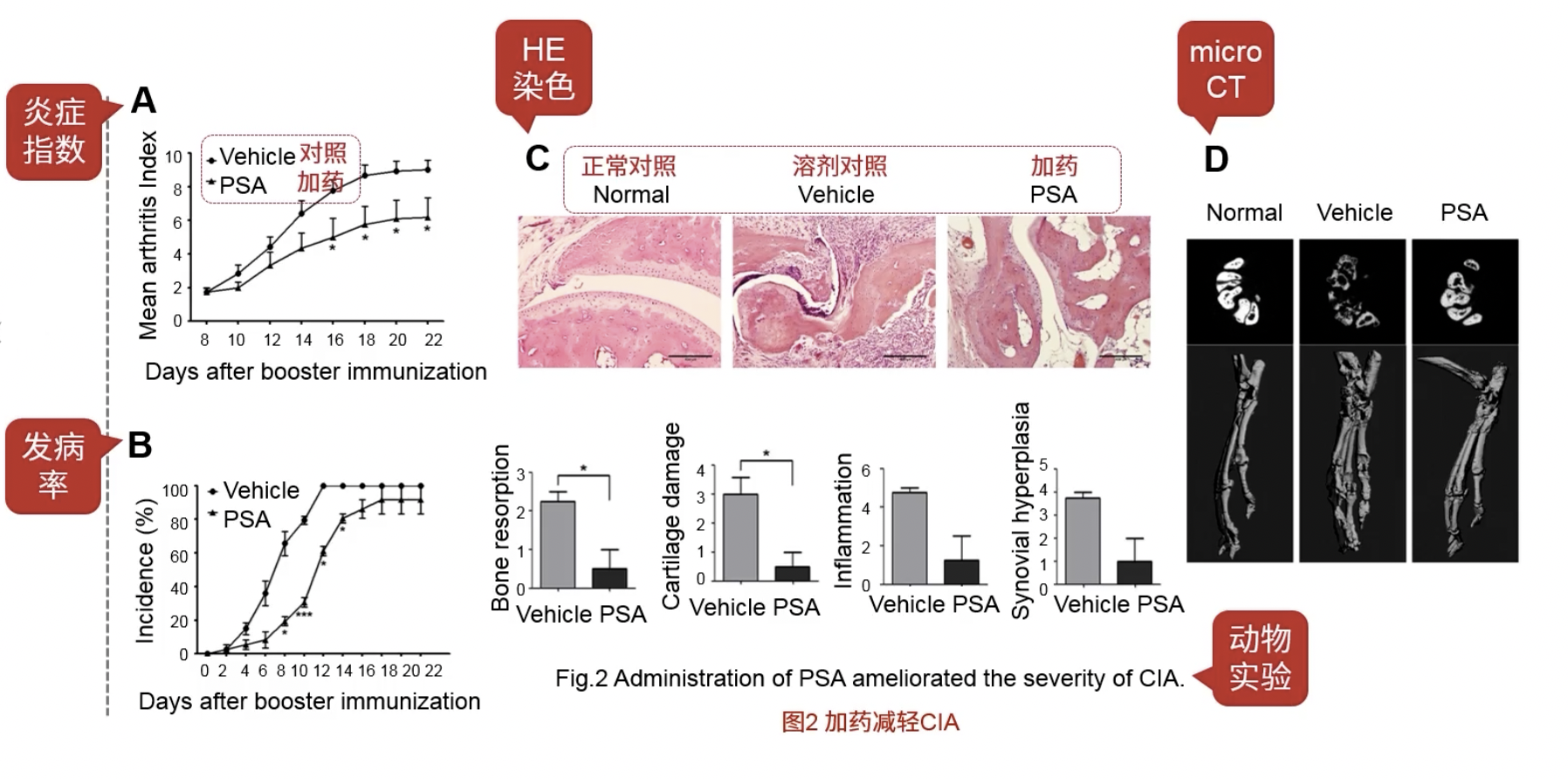
- 动物模型,药物可以改善关节炎的症状
- Fig.2A和B:加药组/对照组,横坐标是关节炎指数和发病率,加药组的这俩指标都低于对照组
- Fig.2C和D:HE染色和microCT分析了药物对关节炎的影响
Fig.3
- 动物实验,加药对体液免疫和细胞免疫的影响
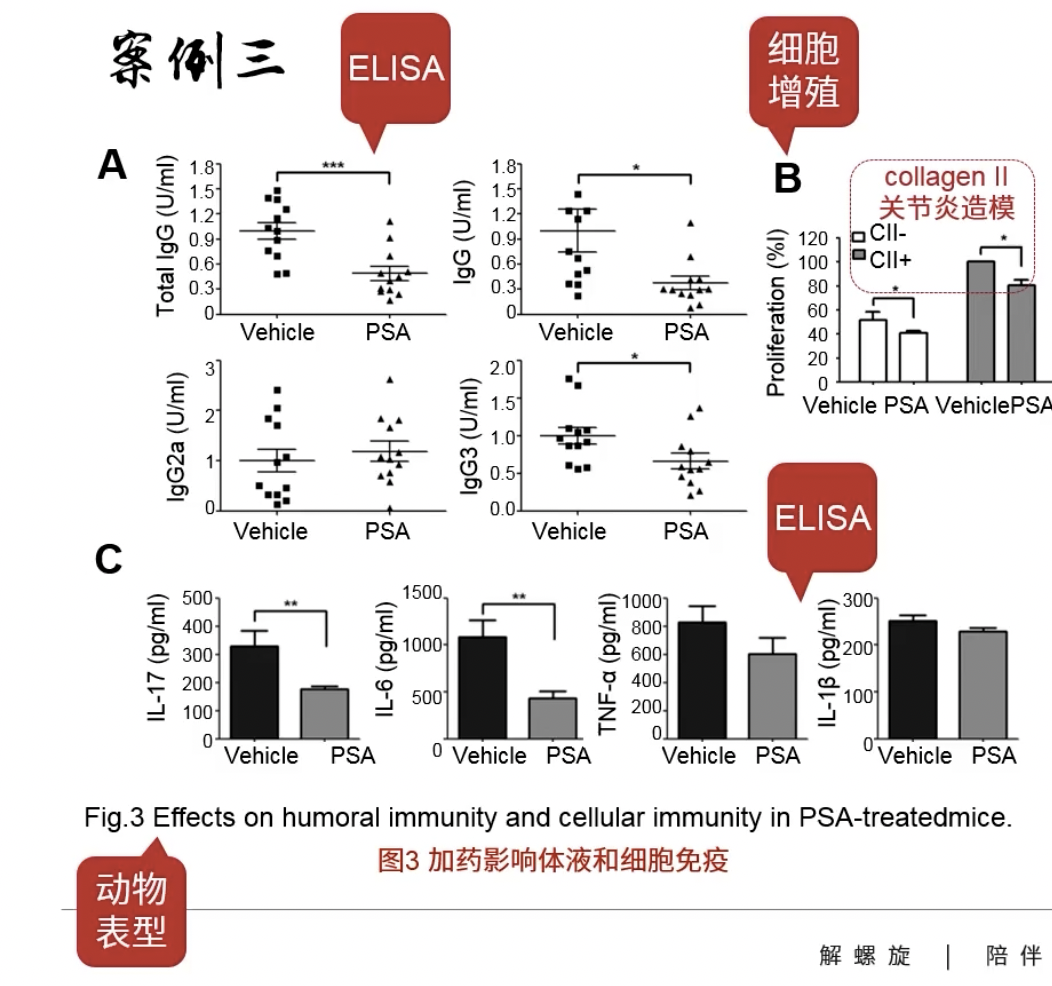
- Fig.3A 加药以后,发现IgG的量下降了,说明影响了体液免疫
- Fig.3B collagen Ⅱ是用来造关节炎模的药物,造模成功后,观察到增殖细胞降低了,说明药物不仅影响体液免疫,还影响细胞免疫
- Fig.3C用ELISA检测了与T细胞分化有关的各种细胞因子,在加药之后IL-17和IL-6显著降低了
Fig.4
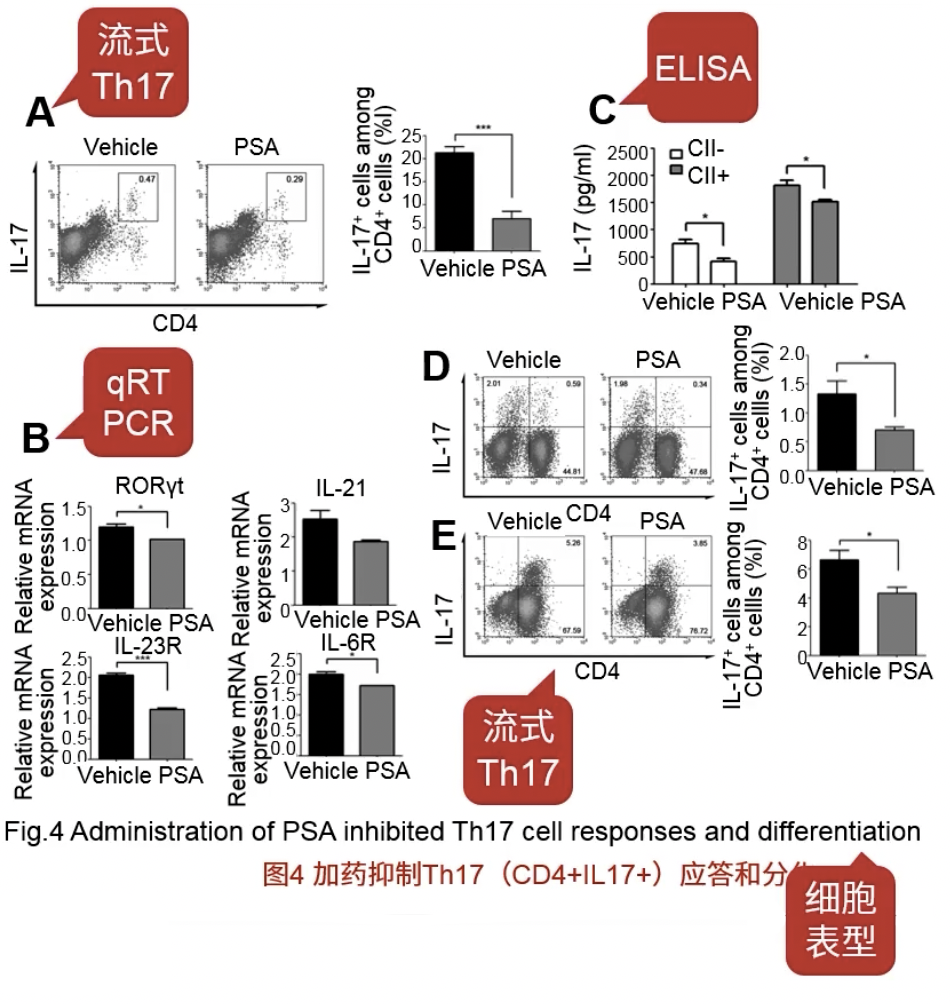
- Fig.4A:流式检测了IL-17和CD4,这俩分子标志物都阳性的细胞就是Th17细胞,在加药后,Th17细胞显著减少了
- Fig.4B用PCR检测了4种RNA的相对水平,这4种RNA对应的表达产物都是促进Th17细胞的分化的,可以注意到在加药后4种分子的量都显著降低了
- Fig.4C在造模后加药,检测IL-17的含量
- Fig.4D、E和Fig.4A没有显著不同,都是在加药后检测Th17细胞群,但是区别在于样品来源不同
Fig.5
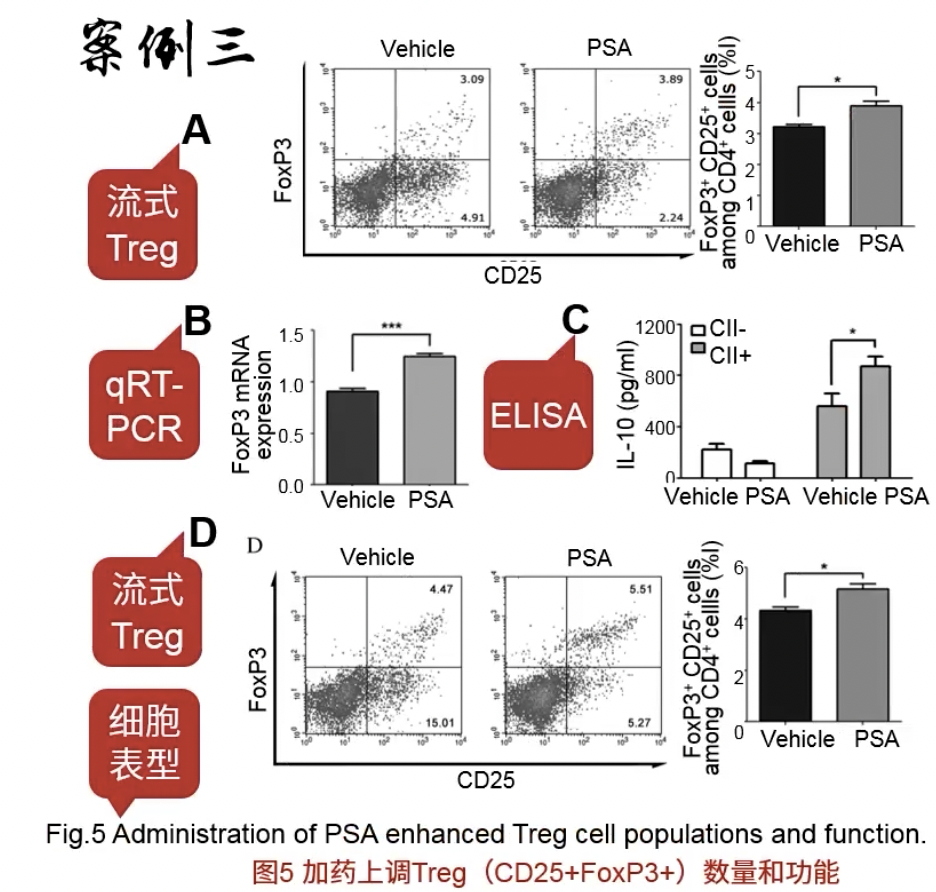
- 做的和Fig.4差不多,都是用流式细胞学、qPCR和ELISA去检测相应的细胞群和细胞因子
- 注意的是分子标记的变化,CD25和FoxP3双阳性的细胞是Treg细胞群
Fig.6
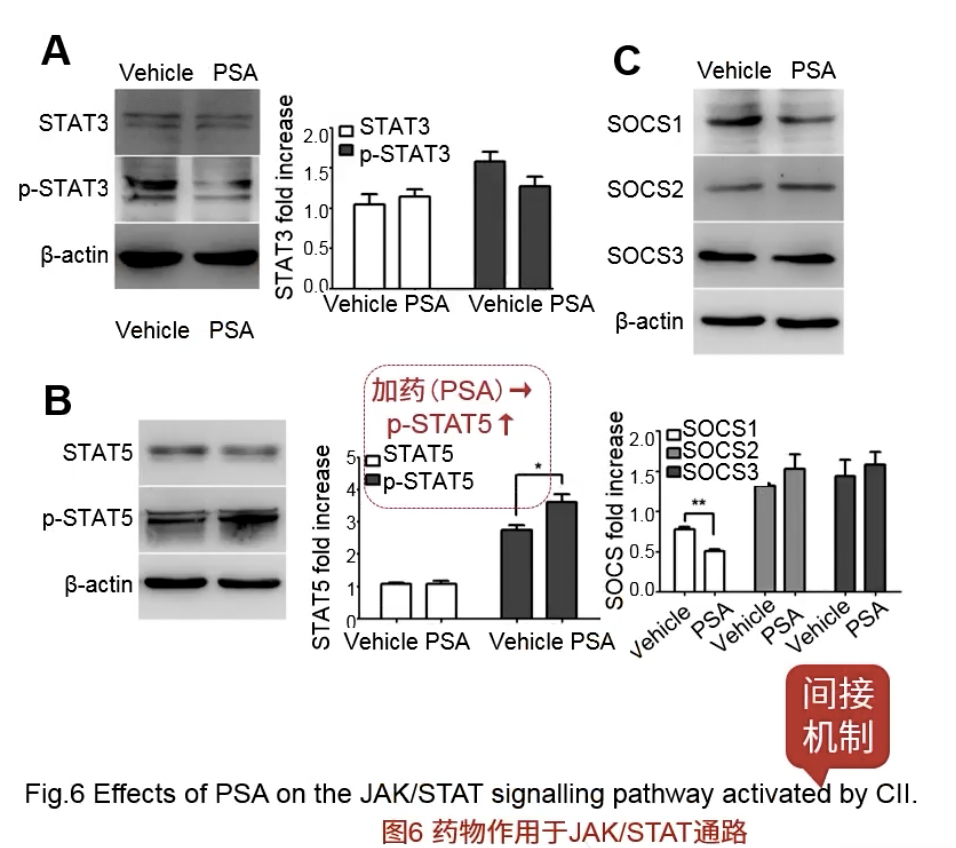
- 文章是有机制的,靠上的是明星通路JAK/STAT
- 检测了一些明星标志物,发现p-STAT5显著增加了,说明激活了STAT通路
总结
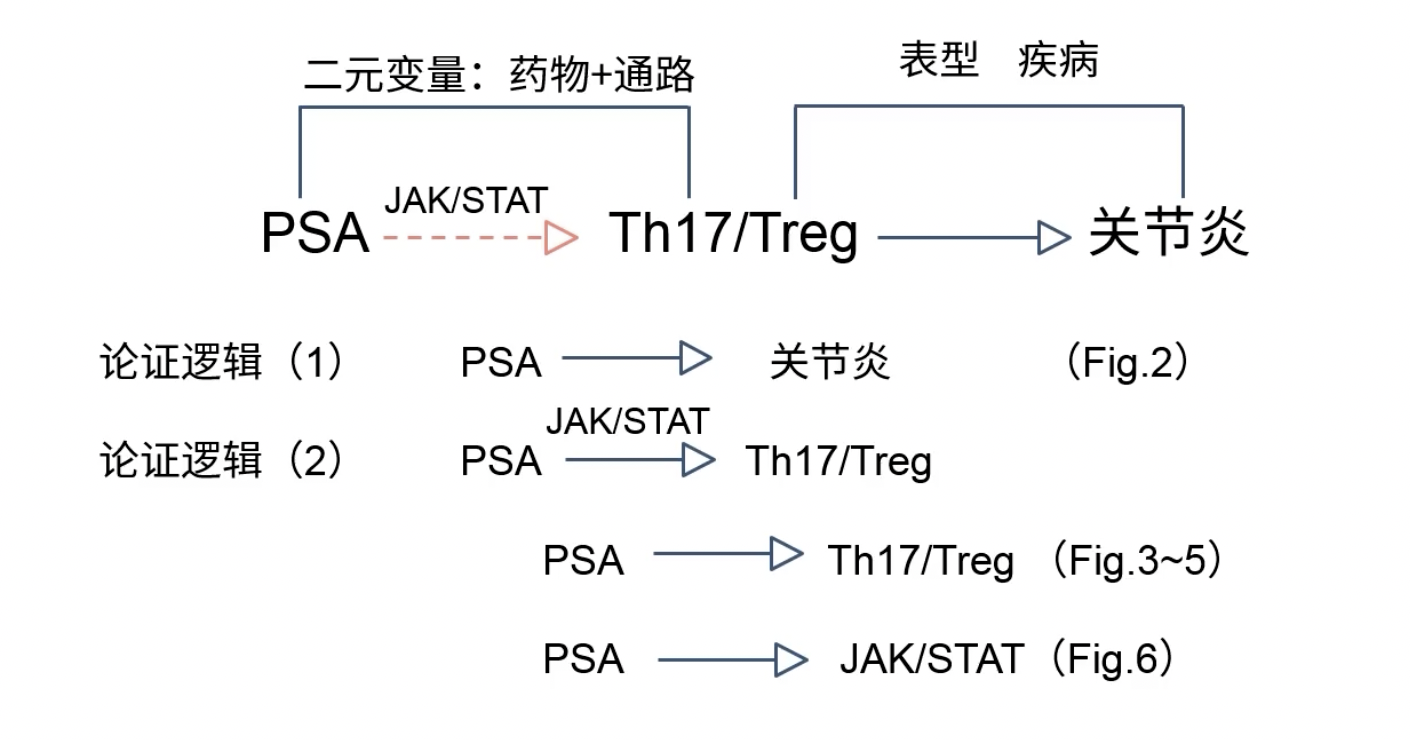
- 没有规范的论证逻辑,缺rescue实验
- 主要的创新点在药物,回答了药物为什么有效的问题



