- 在这一节课的内容里,我们将对各种外泌体分离方法的优缺点加以总结,方便小伙伴们在日后的实验中选择最合适的。
- 外泌体是一种由细胞分泌到外环境,负责细胞间通信的微小囊泡;根据条件,选择适合的方法,将外泌体从培养上清、血液、尿液以及乳汁等等生物体液中分离出来,是我们在这一节要讲解的内容。
外泌体的分离方式
各种分离方式简介
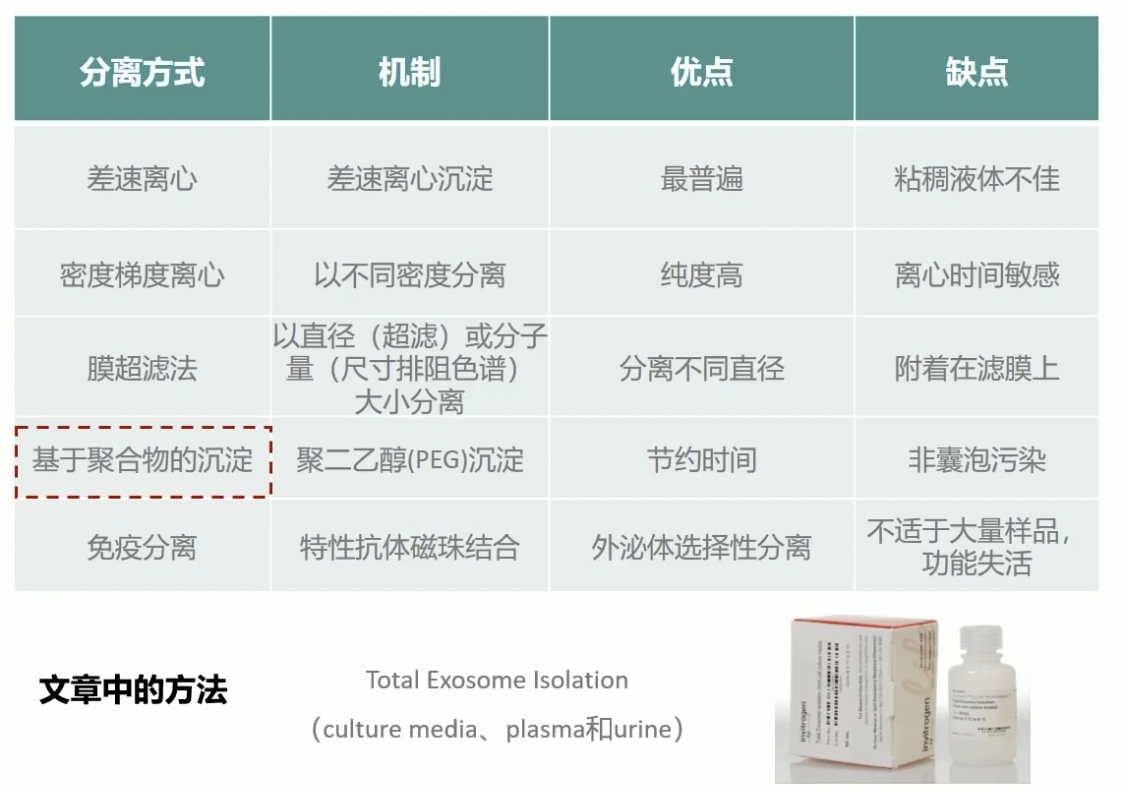
在我们这篇文献当中,应用的分离方式是第四类,是基于聚合物,也就是PEG沉淀的方法,采用的是THERMOL的试剂盒。
最经典:差速离心的方法
- 这种方法的机制是利用超离的离心力把外泌体沉淀下来。这个方法是目前发表文献中应用最多的,大概可以占到一半以上。采用这种方法,最大的缺点是对血浆这种粘稠的液体分离效果不佳。
密度梯度离心法
- 利用碘克沙醇等配置不同密度的溶液,利用密度梯度将外泌体悬浮在和它相等密度的液体层里。
- 这个方法的优点是外泌体的纯度非常高,目前的高分文章,尤其是下游实验对外泌体的纯度要求比较高时,这个方法是非常好的选择。
膜超滤法
- 利用过滤或者排阻层系的方法,原理主要是基于外泌体的直径大小把它分离出来。
- 老师觉得它最大的优点是不需要超离,但是它的技术要求相对比较高,而且也无法排除与外泌体大小相近的颗粒等等。
基于聚合物的沉淀
- 市场上商业化的试剂盒提供的方法,利用聚合物沉淀的方法。
- 优点同样也是不需要超离,操作比较容易快速;但是最大的缺点就是非外泌体材料的污染,而且纯度非常低,容易干扰下游实验。
利用免疫学技术分离
- 利用特异性抗体磁珠结合外泌体,将其选择性分离出来。得到的外泌体可直接用于分析DNA或者总RNA的分离,但这个方法最大的缺点是不适合大量的样本,而且可能会造成外泌体功能的失活。
各种分离方法之间的比较
- 在这里推荐一篇论文
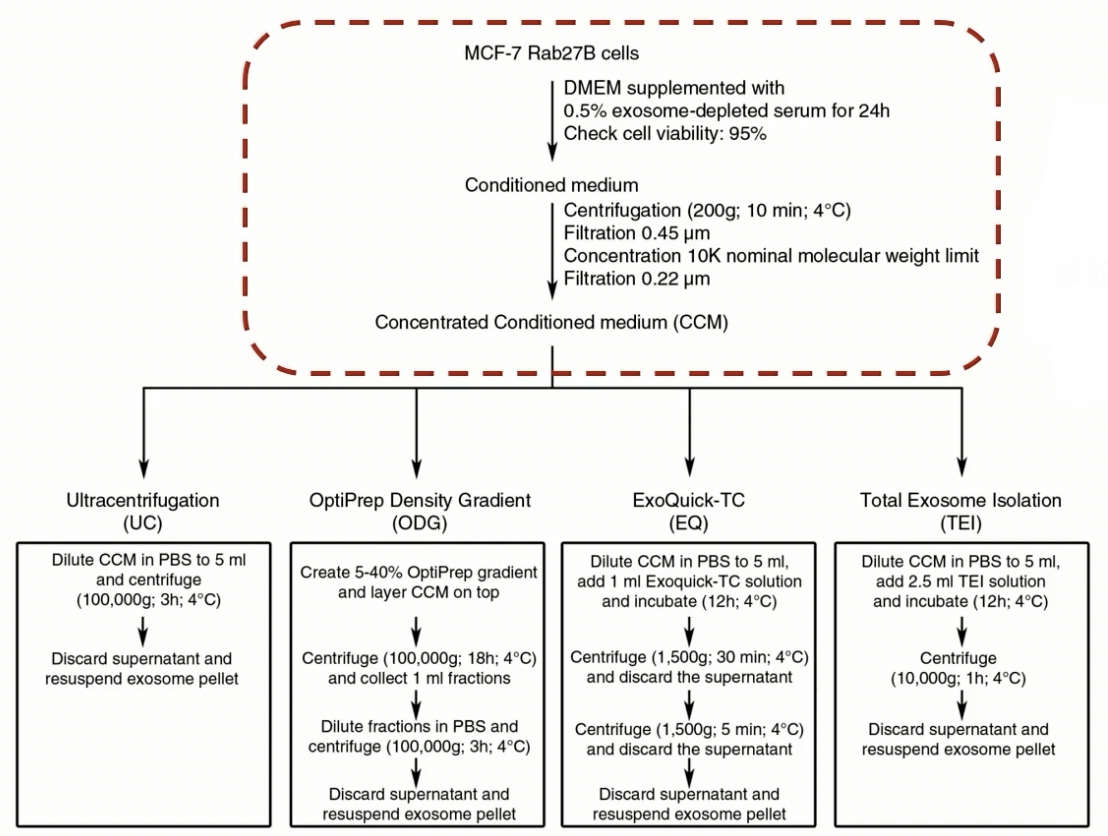
- 上图是分离方法的流程图,我们看到这篇文章用到了四种分离方式,包括了超离,密度梯度离心,以及两种试剂盒的方式。
- 我们先看上面它采用的样本,样本是细胞的培养上清,这种细胞培养上清是采用0.5%去除外泌体的血清培养剂,培养24小时以后收集的,细胞的活率是要大于95%的。
- 收集好培养上清以后,我们就要对培养上清进行处理,在这里作者采用的是膜过滤加超滤的方式。
膜过滤+超滤
- 首先我们要对培养上清中的悬浮的细胞进行处理,我们要去除悬浮细胞,采用的方式是200g离心。
- 第二步就是要用0.45微米的滤膜过滤,去除培养上清当中的细胞碎片。
- 接下来,很关键的一步是用10KD的超滤管进行超滤浓缩;在这里要分享一下,如果我们培养上清当中还有血清,那可以考虑采用100KD的超滤管进行过滤,这样的话可以能够去除一部分培养上清当中血清的杂蛋白。
- 最后一步,作者采用的是0.2微米滤膜的过滤,可以有效的去除这种大的颗粒的影响。
- 总结来说作者的这种膜过滤的方法还是非常值得推荐的,尽管这种方法可能会损失一部分粘在膜上的外泌体,但是对我们后续的分离帮助还是非常大的,可以有效的去除大的颗粒和蛋白杂质。可以有效的减少后续实验的样本量,提高我们的产量。
差速离心的方法
- 经典的差速离心方法是采用不同的转速去除悬浮细胞、死细胞以及细胞碎片。
- 这篇文章中,作者采用了膜加超滤的方式,去图袋这种反复离心的方法,既节约了时间也提高了效率
- 经典的差速离心方法超离一遍以后,细胞是要经过PBS的洗涤的;这里分享一下经验,PBS洗涤确实能够有效的去除粘附在外泌体上的一些杂蛋白,但是同样PBS洗涤也会造成外泌体的大量的损失,而且经过测算,损失的效率大概能够达到30%以上,大家可以根据实验的需要来选择。
密度梯度离心
- 如果我们的实验对外泌体的纯度要求比较高的时候,密度梯度离心就非常必要了。
- 它的原理是制造出不同密度梯度的介质液,使外泌体停留在和它密度相同的介质液层面里;最常用的介质液是碘克沙醇,可以自行配置,也可以买Sigma配置好的介质液,商品名OptiPrep。
- 我们可以配置不同浓度的碘克沙醇蔗糖溶液,对应着不同的密度;外泌体是囊泡结构,它的密度在1.13到1.19之间,与脂蛋白普通的蛋白或者核酸不同,利用密度梯度就可以把外泌体和其他杂质轻易的分开。但是外泌体可能是由于来源细胞的不同,造成密度有轻微的波动;包括我们在配置梯度液的时候,外泌体的密度也会有轻微的不同,所以我们都要做预实验,摸索出外泌体到底是在哪一层,后续实验我们直接吸取那一层的外泌体即可。
- 吸取外泌体后,如果蔗糖和碘克沙醇不影响下游实验,可以不去洗涤,否则则需要再经过超离洗涤下来。
- 这个方法的优点是纯度非常高,缺点是对技术要求也非常高。
PEG沉淀的方法
- 目前市场上采用比较多的是SBI的ExoQuick,和ThermoFisher的Total Exosome Isolatio这两个试剂盒。这两个试剂盒的原理都是相同的,都是利用PEG,也就是聚乙二醇沉淀。
- PEG最早是由于细胞融合的,沉淀外泌体的原理是PEG可以抓取亲脂性的物质。PEG把亲脂性的物质聚集在一起,形成比较大的沉淀团,这个沉淀团采用低速离心就可以把它沉淀下来,因此如果采用PEG沉淀的话,我们就会看到非常大,非常明显的白色沉淀。如果我们采用超离的方式是看不到沉淀的,即便看到也是半透明的极小的颗粒。
- 这个明显的白色沉淀里混杂有各种各样的亲脂性蛋白、核酸、以及PEG等等。这些杂质会跟随我们后续的实验,影响了我们的实验结果,这也是这个试剂盒分离的最大的缺点。
- 在目前发表的文章中,有大概10%的文章采用了这种分离方式,但是现在也确实有这样趋势,文章发表的IF越高、档次越高,也就越多采用这种密度梯度离心的方式,而且最近采用这种试剂盒沉淀得到外泌体所做的文章,也有Review会提出要用差速离心的方法进行对比,看是否能得到相同的结论。
另一篇介绍各种分离方法差异的文章

- 上图也是一篇关于外泌体分离方式对比的文章,我们可以看到:差速离心和PEG沉淀的方法得到的外泌体的杂质比较多,尤其是PEG的方式;而密度梯度离心,无论是蔗糖重水还是碘克沙醇,都能得到相对比较纯净的外泌体,而且我们发现点克沙醇的产率也相对会高一些
免疫分离的方法
- 在这里举例的是ThermoFisher免疫磁珠的方式,这个方法比较简单,不需要超离,1个小时就可以完成,目前在外泌体亚类的研究也非常热门。
- 利用这种方式可以根据实验需要,分离出表达不同标志的外泌体的亚类,有ThermoFisher提供的商品化的试剂盒。
总结
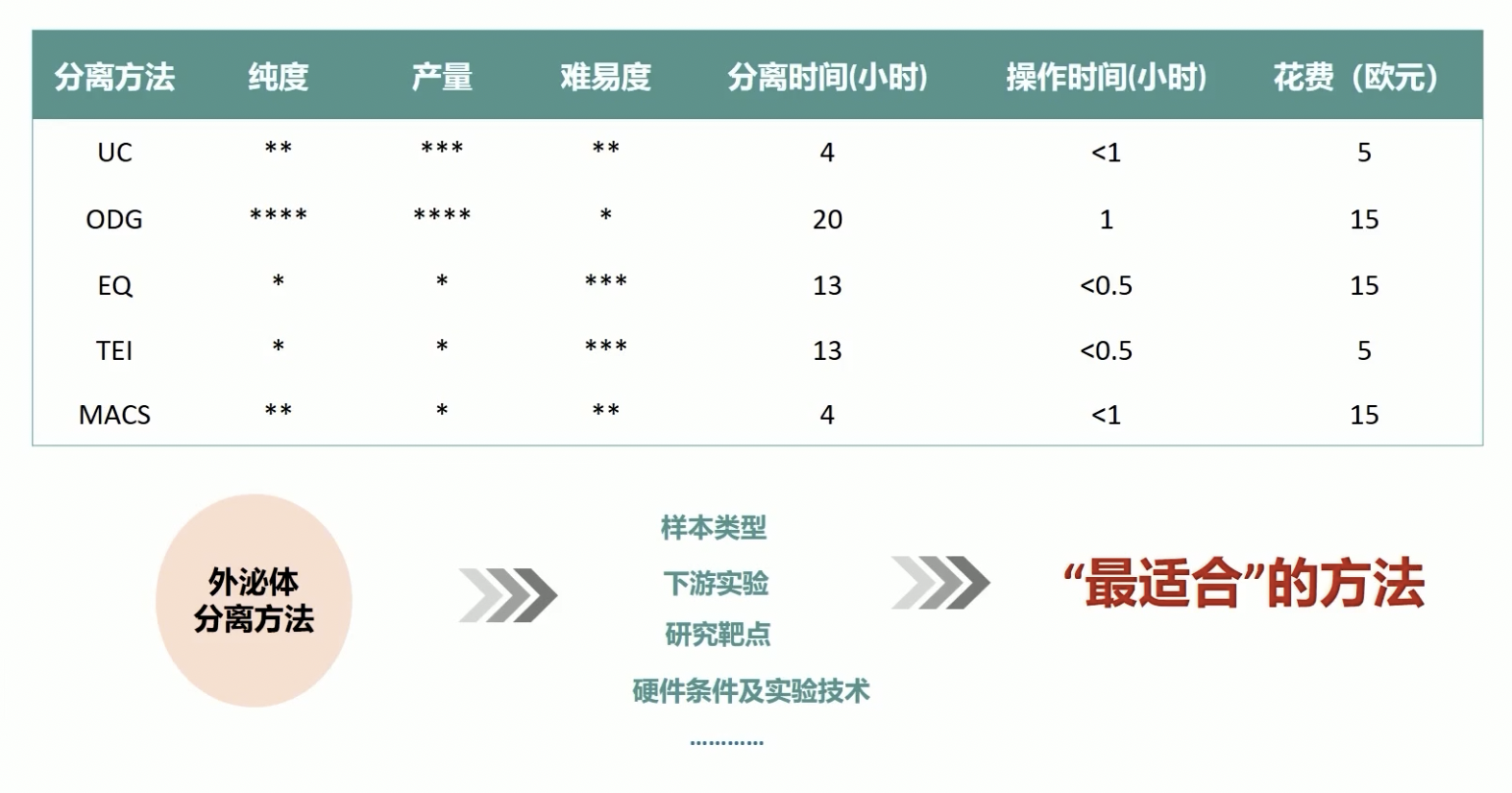
我们可以根据自己的实验需要进行选择,不一定就非要选择其中一种,可以根据自己的实验需要将两种综合起来使用。
没有最好的分离方法,只有最适合自己实验的分离方式。
外泌体分离实验流程
样本的收集与保存
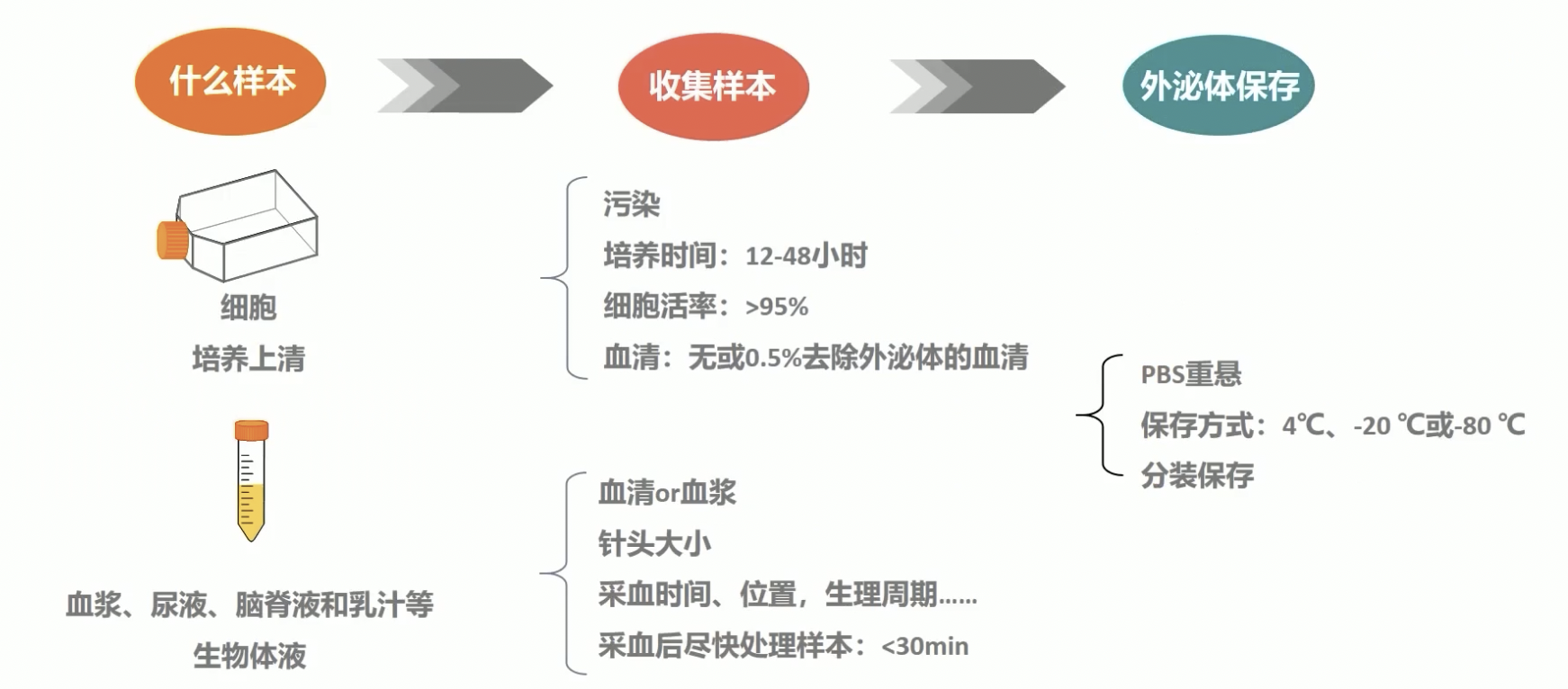
- 首先,让我们先来说一下外泌体样本的收集与保存。为了方便讲解,我们把它分为两个大类,一类是培养上清,一类是血浆尿液等等生物体液。
培养上清
- 培养上清最大的优点是不受样本量的要求,而且取样比较方便
- 但是,它在收集过程中,我们还是需要注意几个问题
- 第一是污染,有污染的样本是肯定不能收集的;在这里要注意一点,我们在做一些特殊的细胞样本是带有病毒基因组的,在培养过程中可能会释放一些病毒颗粒,这些病毒颗粒的大小与外泌体类似,对我们后续外泌体的分离会造成影响的,所以我们在进行外泌体分离的时候一定要注意这一点。
- 培养时间:一般的培养时间是12到48个小时,因为12到48个小时细胞就会有外泌体释放出来,但是在一些特殊药物处理的情况下,细胞可能会在更短的时间,就释放出外泌体。
- 细胞活率:一般情况下细胞的死亡率是不能超过5%的,也就是细胞的活率要大于95%。因为细胞死亡后会释放出各种小体,影响我们的下游实验研究。
- 非常重要的血清的问题:如果细胞可能够耐受的,可以选择无血清的培养剂;如果细胞不能耐受,那也一定要选择去除外泌体的血清;这种去除外泌体的血清可以买到商品化的,也可以自己来制作。
生物体液类样本
- 我们先来说一下最常用的血液:
- 我们知道血液可以分离出血清,也可以分离出血浆,一般情况下血浆样本会更为合适,在凝血过程中血小板会分离出大量的外泌体,干扰我们的实验结果;不过如果我们要是研究和血小板相关的疾病的时候,血清可能更为合适。
- 针头的大小:有一些文献报道说,21号针头可能会更适合一些。
- 采血时间,采血的位置以及生理周期等等:在收集样本的时候,我们应该尽量做到一致。
- 样本的处理时间:我们应该在采血后三十分钟之内处理好样本,因为血液中的白细胞、血小板等会分离大量的外泌体。
- 外泌体的保存:一般分离好的外泌体,我们会用PBS溶解;如果我们下一步是为了分离外泌体内的RNA等等。我们可以直接把外泌体溶解在Trizol等裂解液里,保存方式一般都是低温保存。
- 有一些文献报道,长期的低温保存会对外泌体造成影响,尤其是冻融的影响,在这里我们要根据下游实验的使用时间来进行选择保存方式;如果我们几天内就使用的话,可以放在4°C里,以防止冻融造成的影响。如果我们是分批次收集外泌体,分批次进行实验的话,最好是所有的外泌体都经过同样的处理,同样的冻存方式,以保持我们实验的平行性。
- 我们进行电镜或者粒径检测外泌体的时候,冻融会造成外泌体的粘连。所以我们在进行电镜或者粒径检测的时候,一定要使用新鲜分离的外泌体。
- 外泌体的保存:我们要分装保存外泌体



