使用的文献:Hypoxic lung cancer-secreted exosomal miR-23a increased angiogenesis and vascular permeability by targeting prolyl hydroxylase and tight junction protein ZO-1

- 在之前的两节课程中,我们介绍了miRNA的很多基础知识和背景知识,各位对miRNA应该已经产生了一些总体性的认识和理解。接下来,我们会开始为大家解读这篇精读文章的详细数据,并整理这篇文章的研究逻辑和脉络。
文章的相关背景
背景知识:肿瘤微环境
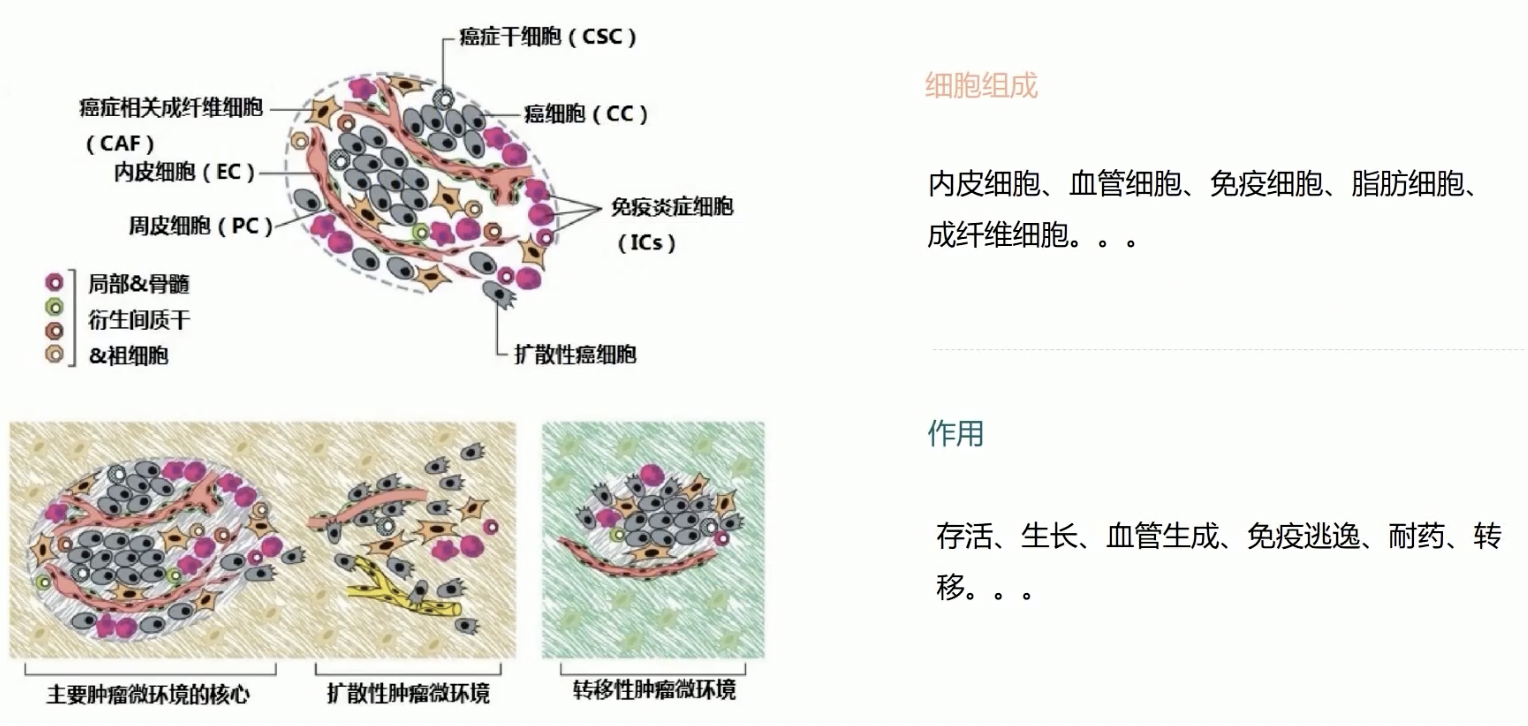
- 肿瘤微环境的概念:肿瘤的发生、生长和转移与肿瘤细胞所处的内外环境有着密切的关系。肿瘤微环境不仅包括了肿瘤所在组织的结构、功能和代谢,而且也和肿瘤细胞自身的内在环境有关。
- 肿瘤与环境,两者既是相互依存、相互促进,又是相互拮抗和相互斗争的,肿瘤微环境的概念是现代肿瘤生物学的一个关键和核心的问题
- 肿瘤微环境主要通过重塑细胞外基质ECM,产生生长因子、细胞因子和趋化因子,直接或间接地支持肿瘤的存活、生长、血管生成、免疫逃逸、耐药和转移等现象。
- 肿瘤微环境主要包含以下的细胞组分:内皮细胞,血管细胞、免疫细胞、脂肪细胞、成纤维细胞等,每一种大类的细胞类型之下,还能区分出很多种细胞亚类,这些细胞与细胞之间存在相互作用,它们也与肿瘤细胞之间存在一定的相互影响,共同创建了一个复杂的网络结构,而且两两之间常常存在双向调节。
- 肿瘤微环境是一个非常庞大且复杂的问题,没有任何一篇文章能够涵盖肿瘤微环境的全部内容,在做具体研究的时候,都是从肿瘤微环境这个大概念中进行细化,研究其中具体的某一个小问题
- 以这次精度的文章为例,研究人员研究的具体问题是肿瘤细胞通过特定的信号通路,诱导内皮细胞形成血管,研究的问题是血管新生,研究的细胞类型是内皮细胞
血管新生表型
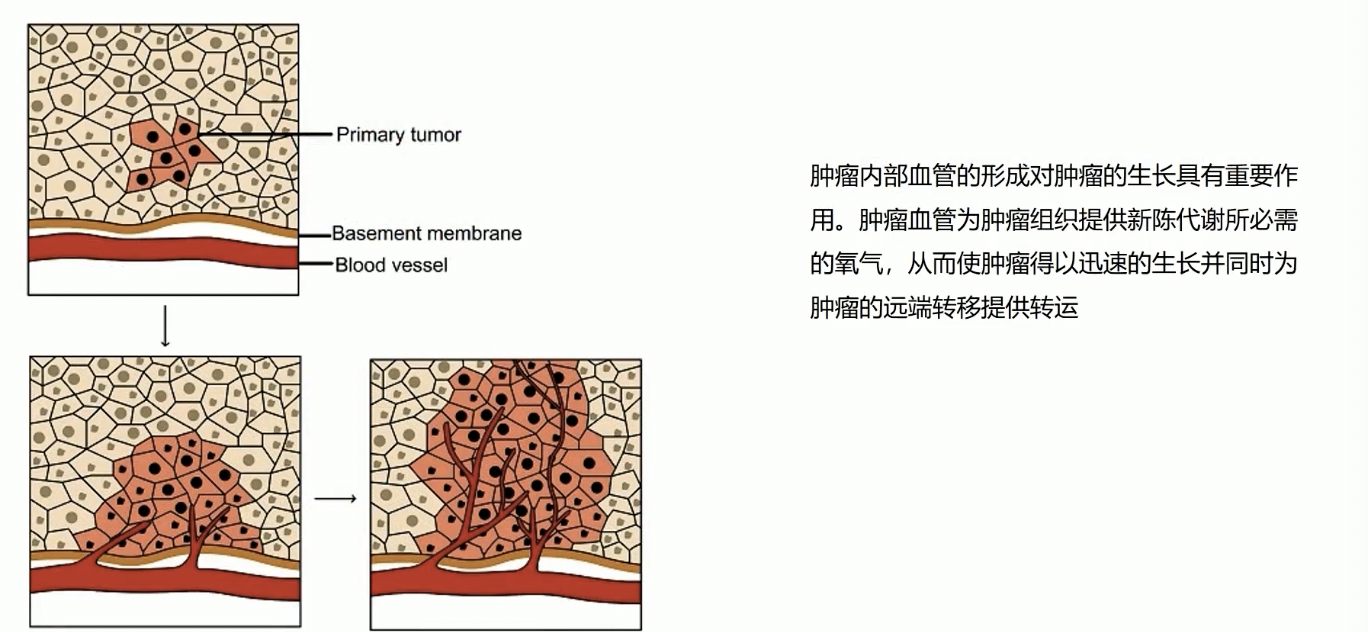
- 新生血管对肿瘤组织的生长至关重要:肿瘤组织块的直径或厚度在达到1~2毫米时,由于肿瘤组织的细胞结构致密,而且氧气和养分的渗透能力也非常有限,因此当肿瘤发展到一定阶段时,就开始通过特定的信号通路诱导内皮细胞形成肿瘤内部的新生血管。
- 而且由于肿瘤诱导的新生血管,其形态和功能都和正常的血管有很大的差异,比如肿瘤内部的新生血管通透性很好,这就意味着血管的选择性很差,物质可以很自由地进出血管,造成血管通透性增加的原因就是血管内皮细胞之间的紧密连接减弱。
- 因此,肿瘤细胞通过这些肿瘤内部的新生血管,不仅可以获得氧气和养分的供给,而且肿瘤内部的新生血管也为肿瘤转移,进入循环系统提供了便利。因此,肿瘤的新生血管一直都是肿瘤研究领域内的热点问题之一。
HIF-1ɑ信号通路
- 正常组织中,氧气浓度为2%~9%,所谓缺氧,指的就是组织中氧浓度低于2%。缺氧微环境是实体肿瘤内客观存在的普遍现象。由于肿瘤的迅速生长,新生血管发育缓慢,而且血管分布异常,即使直径小于1厘米的实体肿瘤,也有缺氧微环境的存在。
- 严重的缺氧可以引起正常组织和肿瘤组织的死亡,但是肿瘤细胞通过自身的调节和基因的改变,可以生成更多的血管生成因子,例如血管内皮生长因子VEGF,血小板原性生长因子PDGF等等。通过这种方式,肿瘤细胞促进肿瘤内部新生血管的形成,提高肿瘤细胞内部氧气的供应。
- 肿瘤细胞能够适应缺氧的微环境,并能生存下来的先决条件是缺氧诱导因子的激活和稳定表达。
- 缺氧诱导因子Hypoxia Inducible Factor (HIF)是肿瘤缺氧反应中的关键性因子。通过调节葡萄糖的吸收和代谢,新生血管的生成,细胞增殖和凋亡等相关基因的转路和表达,有利于肿瘤细胞在低氧环境下的生存和生长,改变了肿瘤的生物学行为,增加了肿瘤的恶性程度。
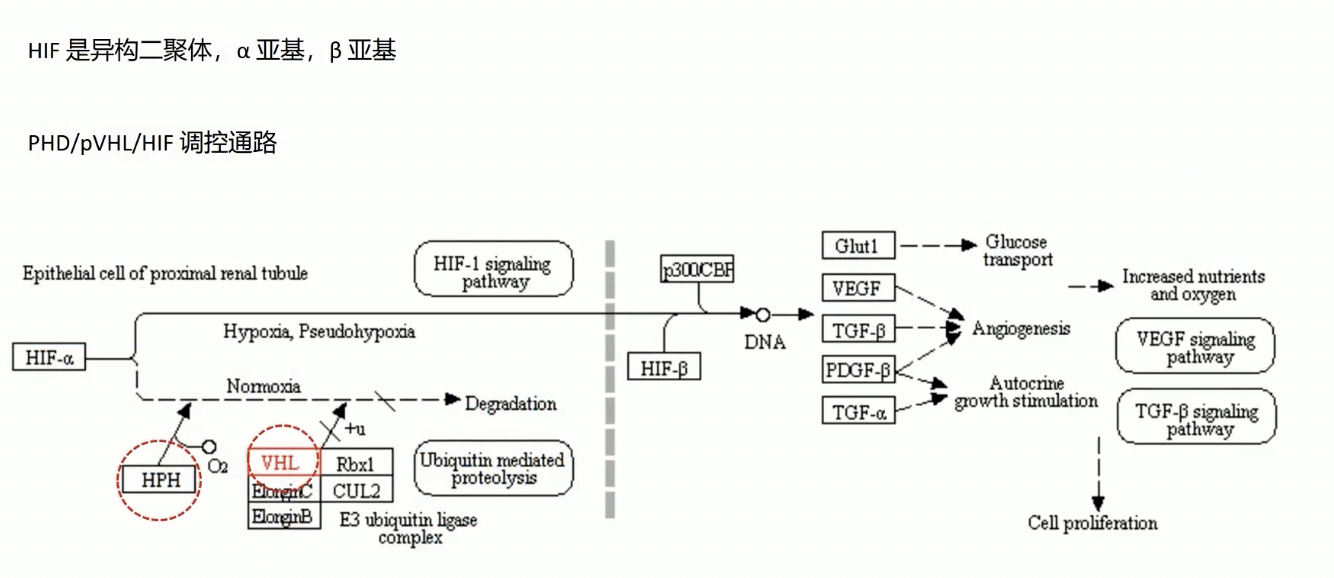
- HIF是由氧敏感的α亚基和结构性表达的β亚基所组成的异构二聚体。HIF-1α广泛存在于哺乳动物组织中,可以上调一系列与糖代谢、血管生成、细胞增殖、侵犯和转移等有关的靶基因的转路和表达,是细胞缺氧反应的重要调节因子。常见的调控HIF的细胞内信号通路是PI3K/Akt-HIF-1α通路或者是MAPK-HIF-1α通路。在本篇精读文章中,作者研究的并不是上述两条常见的HIF调控通路,而是PHD/pVHL/HIF调控通路。在模式图当中,HPH就是PHD,VHL就是pVHL。
- 在常氧条件下,PHD作用于HIF-1α,并使得HIF-1ɑ发生羟基化,这个过程需要氧气的参与,羟基化以后的HIF-1α可以在pVHD的介导下发生泛素化,最终被降解,因此在常氧条件下,HIF-1α在细胞内的表达量很低。
- 在缺氧条件下,由于氧气浓度很低,PHD介导的HIF-1α羟基化反应难以进行,使得HIF-1α的泛素化降解减少,最终导致细胞内HIF-1α的积聚,并导致HIF-1α下游转录活性的极大激活。
外泌体
- 参考复习的内容
- 外泌体是一类多型性囊泡样小体,可以由各种类型的细胞分泌;外泌体发源于细胞内吞系统中的晚期内体late endosome或多囊泡内体,直径大多见于30-100nm,也有认为30-150nm之间,标准并不同意,但是一般认为直径不会超过200nm
- 在电子显微镜下,可以看到外泌体由双层磷脂分子包裹,形态呈扁形或球形小体,在体液中的存在形式以球形结构为主,通常可以通过蔗糖密度梯度离心获得 富集
- 外泌体广泛存在,并且存在于各种体液中,外泌体携带并传递各种重要的信号分子,形成了一种全新的,细胞间信号传递的系统,影响细胞的生理状态,并且和多种疾病的发生和进展密切相关。
- 外泌体的成份中,含量最高的是蛋白,外泌体所含的蛋白种类非常丰富,大致可以分为6类:
- 外泌体中普遍存在,参与结构形成的蛋白质,大多分布于外泌体的表面或内腔中,包括微管蛋白、肌动蛋白和微丝结合蛋白等细胞骨架成分
- 膜转运和融合相关蛋白,比如annexin,多种Rab蛋白等等
- 信号分子:蛋白激酶
- 大量与外泌体生成相关的4跨膜区蛋白成员,比如CD9、CD63、CD81和CD82等,这一类蛋白由于和外泌体的产生相关,所以可以成为外泌体的marker分子
- 抗原提呈分子MHC- Ⅰ类以及热休克蛋白HSP70和HSP90等
- 与细胞来源有关,相对特异,有些外泌体中甚至包含其来源细胞中的大部分种类
- 除蛋白质之外,外泌体中还含有大量mRNA和miRNA,外泌体不仅保护体外RNA稳定存在,还能作为有效的载体,把RNA转运到相应的靶细胞中,发挥重要的调控作用
- 肿瘤来源的外泌体中,miRNA的存在极为普遍,而且丰度较高,在肿瘤的自身调控中发挥了重要作用,目前发现RNA含量丰富的外泌体既参与细胞之间的遗传信息和信号通路的传递作用,在肿瘤微环境中起到了重要的物质传递和信号传递效应。
紧密连接
- 将两个细胞间紧密相连的区域,从而在两个细胞间构建起一个液体无法穿透的屏障,是一类复杂的细胞连接复合物
- 紧密连接主要执行三种重要功能:
- 将细胞固定在一起
- 保持细胞的极性,防止具有极性分布的膜蛋白发生扩散
- 防止分子、离子穿过细胞间隙,使物质必须通过主动转运的方式才能进入细胞内。紧密连接的功能提供了控制物质选择性通过的能力
- 紧密连接是一个复杂的结构,主要由三种蛋白组成:
- 跨膜蛋白:存在于细胞膜上,跨膜蛋白的细胞内结构域和胞浆中的支架蛋白相衔接,比如ZO-1蛋白
- 支架蛋白:将跨膜蛋白固定在周围的肌动球蛋白上,跨膜蛋白和细胞骨架的肌动球蛋白相互作用,对于维持紧密连接的功能是十分重要的
- 肌动蛋白
- ZO蛋白是紧密连接的特异性蛋白,目前明确的ZO蛋白有三个,分别是ZO-1、ZO-2和ZO-3;ZO-1是目前研究比较多,且功能较为明确的分子
- ZO蛋白在细胞内为紧密连接提供类似于“脚手架”scaffold的作用,调节紧密连接的功能和维持紧密连接的结构
Fig.1
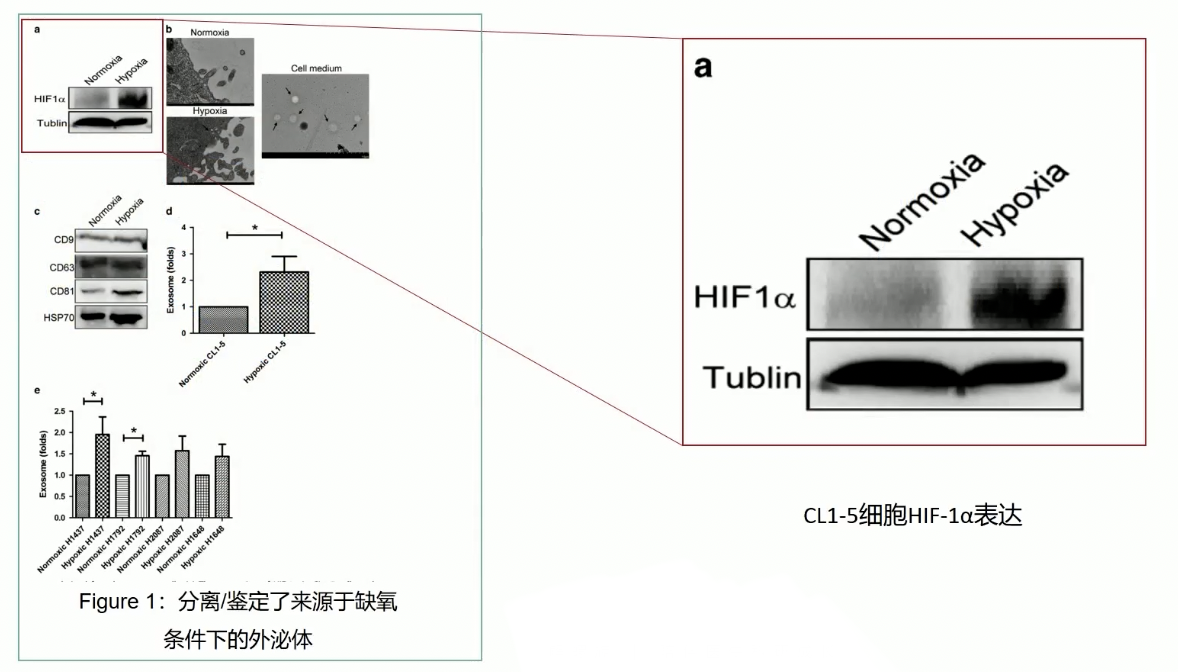
- 分离鉴定了来源于缺氧条件下的外泌体,作者选用1%的氧气浓度作为体外模拟缺氧的实验条件,对照的常氧条件是20%的氧气浓度。
- 在缺氧条件下,细胞内缺氧诱导因子HIF-1ɑ的表达显著升高,通过检测HIF-1ɑ的表达水平,证实了1%氧气浓度模拟体内缺氧的实验条件是可靠的
- 由于外泌体的主要特征是:1)直径小于200nm;2)外泌体有特异性的蛋白marker,因此研究者从常氧和缺氧条件下,分离的外泌体分别通过透射电镜和WB实验,验证常氧和缺氧条件下,肿瘤细胞CL1-5确实可以分泌外泌体
- 首先通过透射电镜,可以在细胞内和细胞培养的培养基当中,检测到直径<200nm的外泌体囊泡,同时WB结果也证实,在分离获得的外泌体结果样本中,外泌体特异性的蛋白marker CD9、CD63和CD81以及HSP70等蛋白都有显著的表达,而且这些外泌体蛋白在缺氧条件下的水平都比常氧下的水平要高,提示缺氧条件下,肿瘤细胞CL1-5可以分泌更多的外泌体。
- Fig.1d是统计结果,提示在缺氧条件下,细胞内生成了更多的外泌体。在Fig.1d中,作者采用的方式是总外泌体蛋白/细胞总数的方式进行统计,也就是作者采用了细胞总数进行了均一化。
- 在Fig.1e当中,作者将CL1-5肺癌细胞中获得的结果进行了推广,因为在另外4种肿瘤细胞中,都可以观察到在缺氧条件下,肿瘤细胞分泌了更多外泌体的现象。
- 总结一下,作者在Fig.1观察到了缺氧条件下,肿瘤细胞分泌更多外泌体的现象。
Fig.2
- 在Fig.2中,作者研究了肿瘤来源的外泌体对HUVEC血管新生的影响。
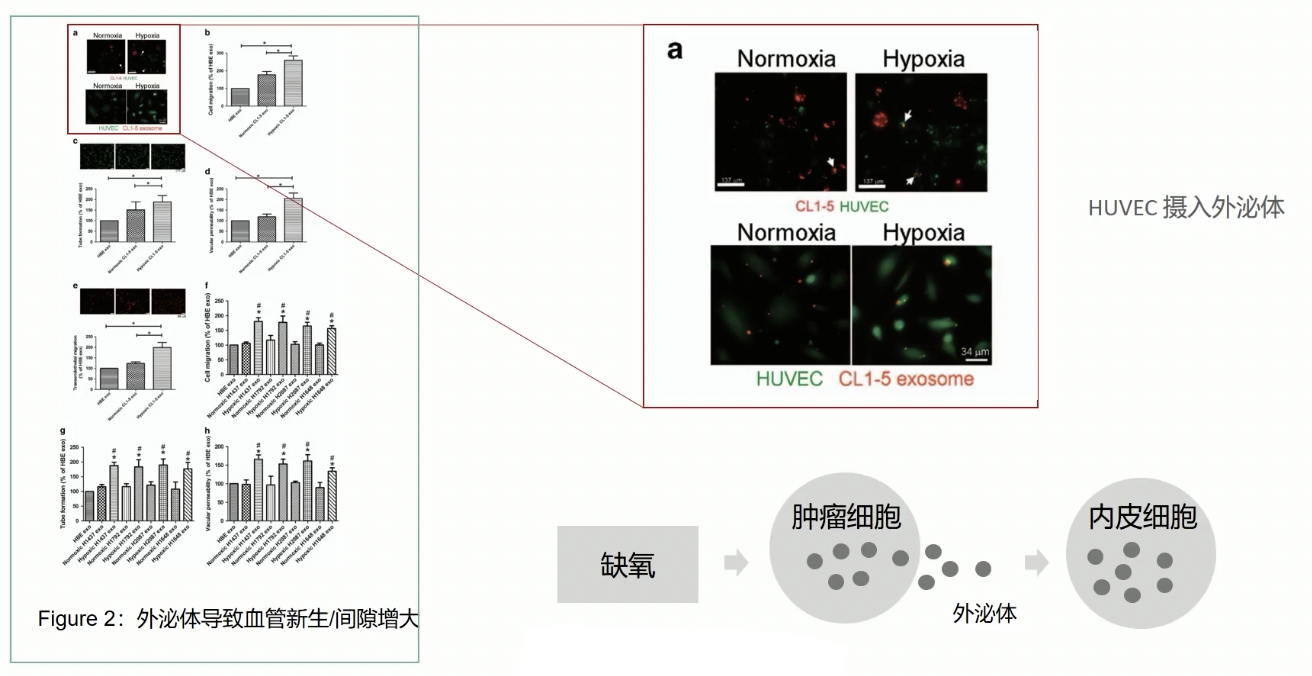
- 在Fig.1中,研究人员已经证实,缺氧会导致肿瘤组织释放更多的外泌体,由此引出的问题是这些肿瘤组织释放出的外泌体有什么功能,研究人员选择的研究方向是探究肿瘤来源的外泌体对内皮细胞的影响
- 在这一步研究中,研究人员首先证明了内皮细胞可以吞噬肿瘤来源的外泌体,作者采用了两种方法:
- 作者首先分离了肿瘤来源的外泌体,然后用染料Dil dye对外泌体染色(将染料与外泌体共孵育),然后再将被染色的外泌体和HUVEC共同孵育3h,最后通过Calcein-AM染料将HUVEC染成绿色
- 结果发现,在绿色的HUVEC细胞内,可以观察到红色的,被Dil dye染色的外泌体,共定位之后呈现出黄色的信号,提示HUVEC可以吞噬肿瘤来源的外泌体。
- 研究者采用的第二种方法是用红色的PKH26染料染色肿瘤细胞CL1-5,另外用绿色的PKH67染料染色HUVEC细胞,再把等量的被标记的两种细胞混合培养3h,同样可以观察到:在绿色的细胞内可以观察到红色的信号,这些信号只可能来源于肿瘤细胞
- 上述两实验证明HUVEC可以吞噬来自肿瘤细胞CL1-5的外泌体,换而言之,肿瘤细胞CL1-5可以通过外泌体与HUVEC产生信号传递
- 到了这一步,接着引出的问题是,HUVEC吞噬了肿瘤细胞来源的外泌体之后,内皮细胞发生了什么变化?作者通过四个方面的实验进行了探究:
- 在Fig.2b的transwell实验中,作者证明内皮细胞在吞噬了外泌体后,内皮细胞的迁移能力明显升高,而且无论是缺氧诱导的外泌体,还是常氧诱导的外泌体都是如此,缺氧诱导的外泌体效果更佳显著。
- 为什么要研究HUVEC细胞的迁移能力:血管新生过程中,会发生内皮细胞从肿瘤组织外部向肿瘤组织内部迁移的过程,一般认为只有内皮细胞迁移到了肿瘤组织内部之后,才能通过血管新生作用,形成肿瘤内部的血管。
- Fig.2b证明了:HUVEC迁移能力增强,已经在提示HUVEC在吞噬肿瘤来源的外泌体之后,通过增强HUVEC细胞的迁移能力,提升了HUVEC细胞血管新生的潜能,果不其然,在Fig.2c中,作者就研究了HUVEC对于血管新生能力的影响。
- Fig.2c中,研究者采用了tube formation实验,在这个实验中,HUVEC首先和不同来源的外泌体共同孵育24h,随后HUVEC细胞和Matrigel混合,在体外构建一个三维培养的模型;在这个三维培养的模型中,以Matrigel为基质的HUVEC会形成类似于网状的结构,通过这个tube formation实验,研究人员证实,缺氧诱导的肿瘤来源外泌体促进了内皮细胞HUVEC形成血管的能力
- Fig.2d中,研究者进一步探究了HUVEC在吞噬外泌体之后,HUVEC的通透性发生的变化,背景介绍部份我们提到过,内皮细胞在肿瘤血管新生的过程中,虽然可以形成肿瘤内部的新生血管,但是这类新生血管的性质和新生的有很大的不同,血管内皮细胞之间的紧密连接减弱,导致肿瘤内部的新生血管通透性很好,作者通过vascular permeability实验证实了HUVEC内皮细胞的通透性异常升高,这个实验类似于transwell转移小室实验:
- 首先在上室的底部铺上HUVEC细胞,并加入不同来源的外泌体进行孵育,接着在上室中加入FITC标记的右旋糖苷,最后在下室中检测FITC标记的右旋糖苷信号,因为右旋糖苷只有穿透HUVEC细胞层,才能从上室渗透到下室中,因此在下室中检测到的FITC标记的右旋糖苷信号越强,HUVEC的通透性就越好,细胞与细胞之间的间隙越大。
- 实验结果证实:缺氧诱导的外泌体孵育之后,HUVEC的通透性显著增大
- 最后一个实验是Fig.2d进行的trans-endothelial migration实验,跨内皮迁移实验,实验原理同样类似于转移小室:首先在上室的底部铺满HUVEC,然后在上室内加入等量的肿瘤细胞,最后在下室内检测发生了迁移的肿瘤细胞数量
- 实验结果证实,在缺氧诱导的外泌体孵育之后,发生跨内皮迁移的肿瘤细胞比例显著增加,细胞与细胞之间的间隙变大,使得肿瘤细胞更加容易发生跨内皮迁移
- 综上所述,研究者通过Fig.2b-e,证明了内皮细胞在吞噬了外泌体之后,内皮细胞的迁移能力增强,新生血管的能力增强,新生血管的能力增强,肿瘤细胞的跨内皮迁移能力增强,这四种能力可以分为两类
- Fig.2b-c证明的血管新生能力增强
- Fig.2d-e证明的内皮细胞与细胞之间的间隙增大
- 最后,Fig.2的f-h之中,研究者把从肺癌细胞系CL1-5之中获得的外泌体结果推广到了其他四种肺癌细胞内,证明这种缺氧诱导的肿瘤来源外泌体具有普适性
- Fig.1-2我们可以总结出:缺氧诱导肿瘤细胞分泌更多的外泌体,这些肿瘤来源的外泌体可以被肿瘤细胞周围的内皮细胞所吞噬,并提高内皮细胞的血管新生能力,也增大了内皮细胞与细胞之间的间隙,基于这个发现,新的问题出现了,外泌体只是一种亚细胞器,具体介导这种效应的分子机制是什么呢
Fig.3
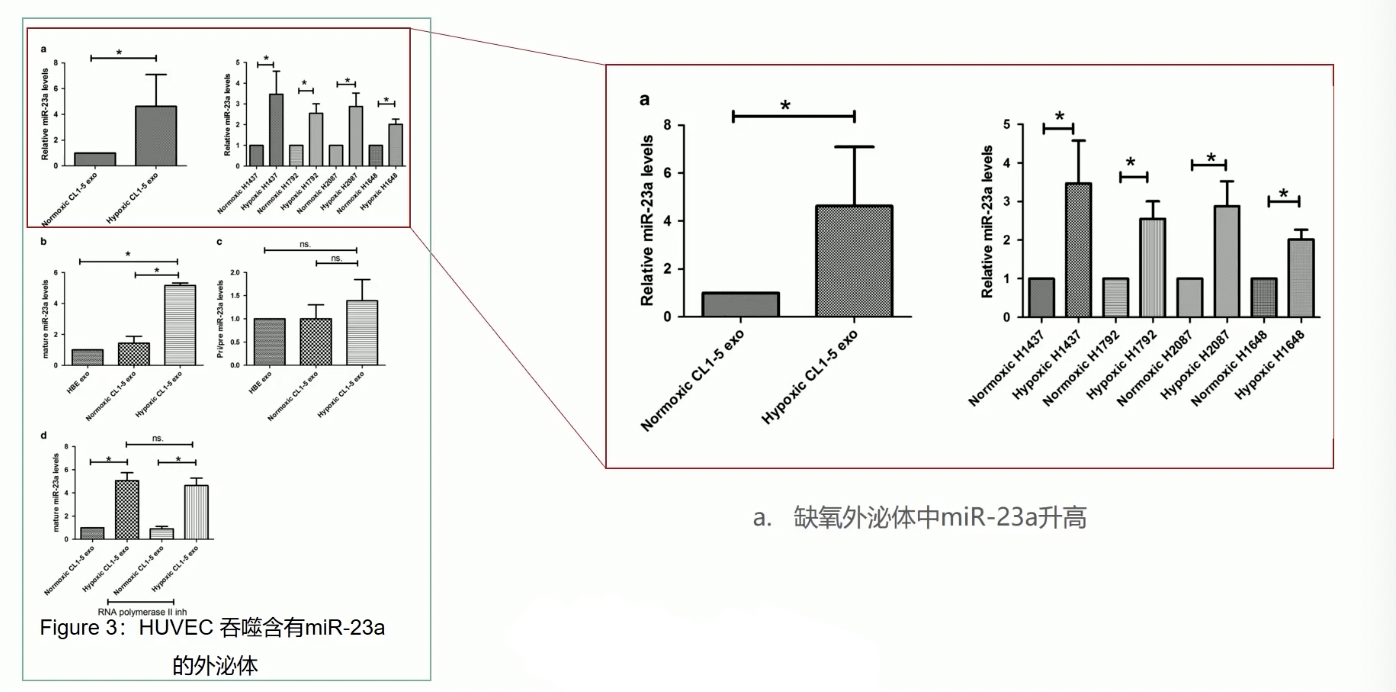
- 研究人员筛选了肿瘤细胞来源的外泌体之中的RNA分子,通过验证证实,在5种不同的肺癌细胞细胞系内,在缺氧诱导的外泌体中,miR-23a的表达水平,要显著高于在对照常氧诱导的外泌体中的表达水平,这些结果说明,缺氧调节可以诱导肿瘤细胞分泌更多含有miR-23a的外泌体
- 由此引出两个问题
- 含有miR-23a的外泌体是否可以被HUVEC吞噬,并且提高细胞内miR-23a的表达量?
- HUVEC吞噬外泌体之后,提高了细胞内miR-23a的表达量,如何介导细胞内的信号转导呢?
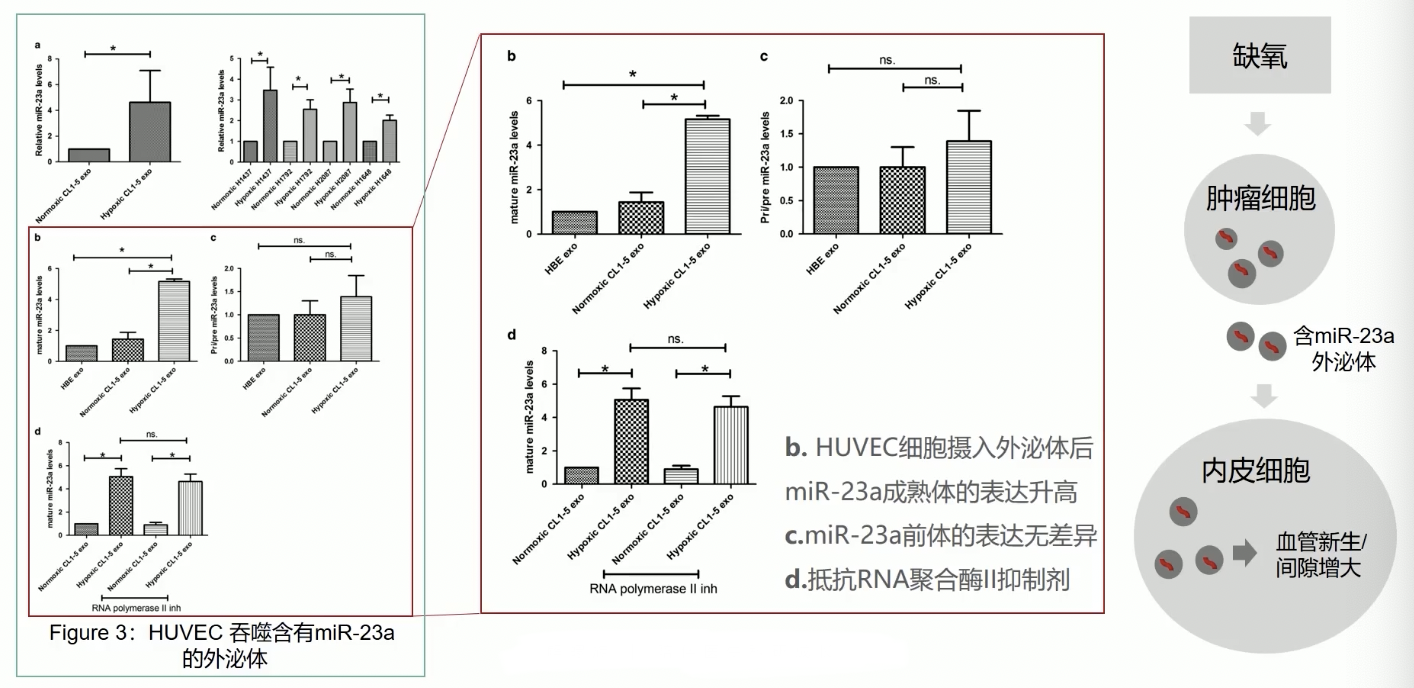
- 研究人员首先在Fig.3的b-d图中回答了第一个问题,HUVEC细胞是否可以吞噬来自肿瘤细胞的,含有miR-23a的外泌体,并且提高细胞内miR-23a的表达水平?
- 补充背景知识:只有成熟的miRNA分子才能通过外泌体,被释放到细胞外;其次,HUVEC细胞本身也会表达miR-23a分子,因此,在吞噬了肿瘤来源的miR-23a分子之后,HUVEC内成熟的miR-23a分子就有两个来源了,Fig.3b-d证实,细胞内成熟的miR-23a表达显著升高,但是miR-23a的前体表达没有显著变化,证实HUVEC细胞内miR-23a的合成途径没有发生变化,因此HUVEC细胞内总的、成熟的miR-23a分子的表达升高,是由于HUVEC细胞吞噬了外源性的、成熟的miR-23a所导致的
- 同理,在Fig.3d中加入了RNA-pol Ⅱ的抑制剂,抑制了HUVEC内源性的miR-23a的成熟机制,但仍然能够检测到HUVEC内成熟的miR-23a表达升高的现象,更加证明了HUVEC吞噬了肿瘤来源的miR-23a的分子,并且导致HUVEC内成熟的miR-23a表达增多的现象。
- 至此,我们可以获得如下的机制:缺氧可以诱导肿瘤细胞合成更多含有miR-23a的外泌体,HUVEC内皮细胞通过吞噬这些外泌体,使得HUVEC细胞内miR-23a的细胞表达水平升高,最终导致HUVEC表现出血管新生现象,和内皮细胞之间间隙增大的现象
Fig.4
- 研究进行到这一步,研究人员开始回答第二个问题,HUVEC吞噬外泌体,并且提高了细胞内miR-23a的表达量之后,通过什么信号通路,影响了血管新生的能力,影响了内皮细胞与细胞之间的间隙?
- 为了研究miR-23a的下游信号通路,研究人员通过生物信息学网站Targetscan, MiRanda and PicTar查找下游靶基因,然后取交集,获得候选的靶基因,再通过Luciferase assay获得miR-23a靶基因之间的调控关系
- 首先,在HUVEC细胞内进行荧光素酶验证时,研究人员采用了两种方法,来升高HUVEC内miR-23a的表达水平,分别是使用miR-23a的mimics,和让HUVEC与缺氧诱导的外泌体孵育,实验结果见下,无论采用哪一种方法,HUVEC细胞内的miR-23a的表达水平升高以后,都显著地抑制了PHD1的表达水平;如果将PHD1与miR-23a结合的区域做突变,那么miR-23a对PHD1的表达抑制作用就消失了,因此miR-23a可以结合到PHD1的3’-UTR区域,并抑制PHD1的表达
- 和Luciferase assay相映证的WB结果也证实,无论用哪种方法,只要在HUVEC细胞内提高了miR-23a的表达量,PHD1和PHD2的表达水平都会显著下降
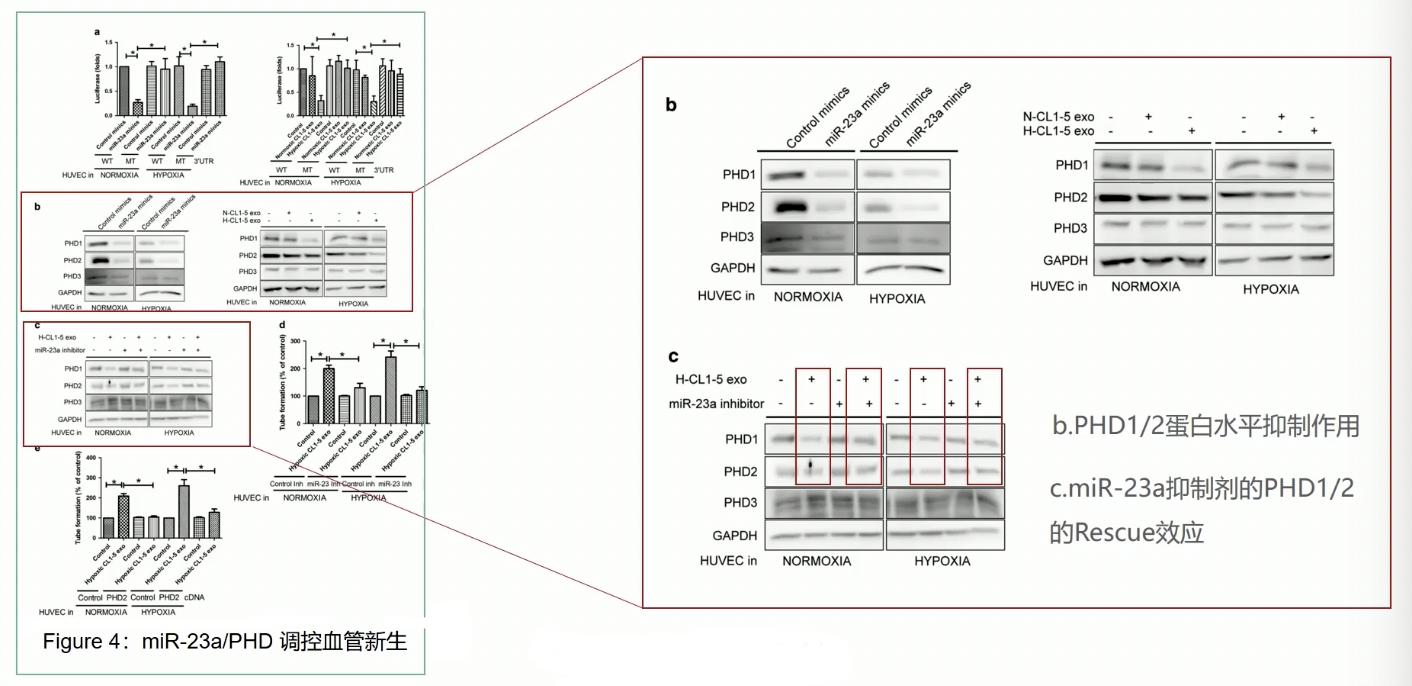
- Fig.4c证实,在和缺氧诱导的外泌体共孵育之后,HUVEC细胞内PHD1和PHD2的表达量都收到了显著抑制,这一结果和Fig.4b是一致的,但是当HUVEC细胞内miR-23a被阻断之后,PHD1和PHD2的表达水平就不会受到抑制,而是和对照条件相一致,也就是被rescue了
- 上述结果表明,HUVEC在吞噬了缺氧来源的外泌体后,通过miR-23a抑制了PHD1/2的蛋白表达,至此我们可以得到结论,在HUVEC细胞内,miR-23a表达升高后,可以抑制下游靶基因PHD1/2的表达
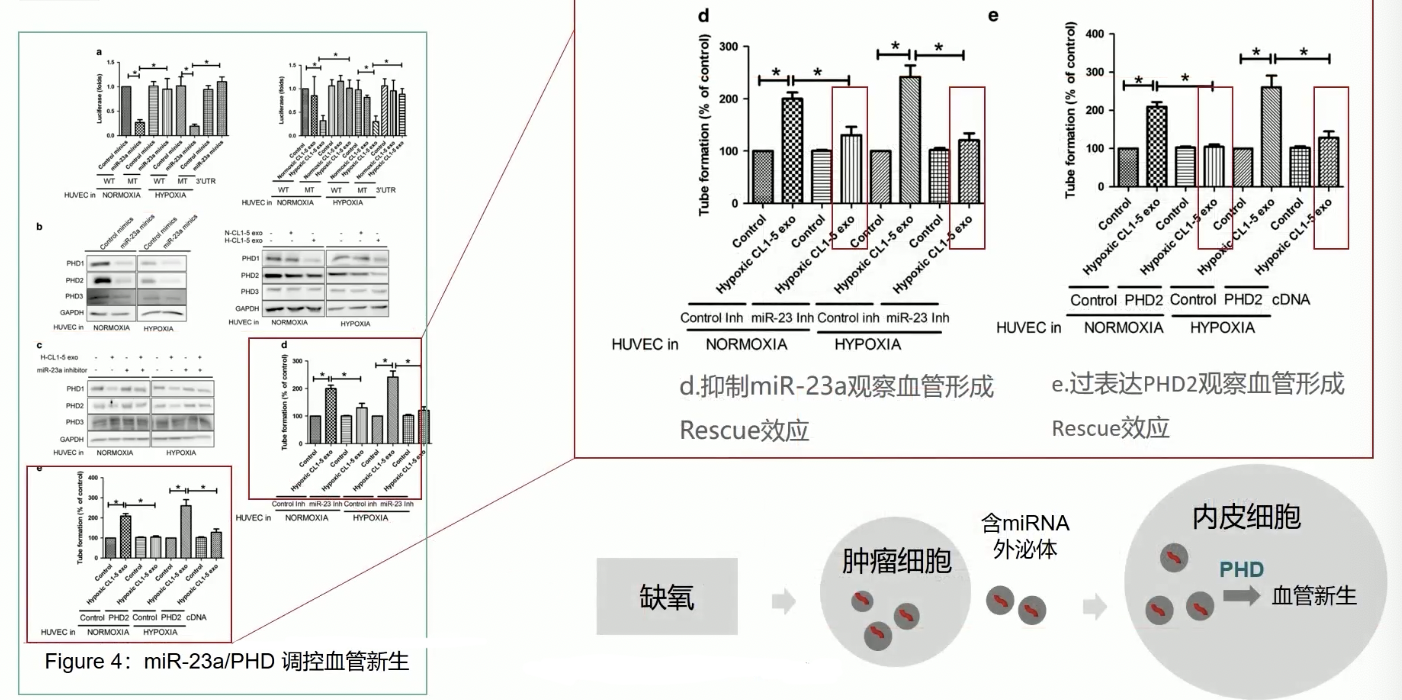
- Fig.4d和4e中,研究人员都证实了miR-23a-PHD1/2信号轴的细胞学功能呢,研究人员通过tube formation实验,证实将HUVEC细胞与缺氧外泌体共孵育之后,HUVEC细胞的tube formation能力显著增强,这个结果和之前的是类似的,但是HUVEC的这种能力依赖于miR-23a-PHD1/2信号轴,因为无论是用miR-23a的抑制剂,还是在HUVEC内过表达PHD2,都能阻断这一条信号轴,也阻断了HUVEC的tube formation能力。
- 基于上述研究结果,我们的机制图可以进一步优化,首先缺氧诱导肿瘤细胞分泌更多含有miR-23a的外泌体,这些外泌体被HUVEC吞噬,细胞内miR-23a表达水平升高,抑制下游靶基因PHD1/2的表达,最终导致HUVEC血管新生能力增强
Fig.5
- 到这一步的时候,研究人员开始了表型拆分,因为miR-23a-PHD信号轴只影响血管新生,不影响内皮细胞之间的间隙增大
- 研究人员在证明了miR-23a-PHD信号轴可以影响HUVEC的血管新生能力之后,还进一步研究了PHD在表达收到抑制之后,如何进一步影响下游的信号转导
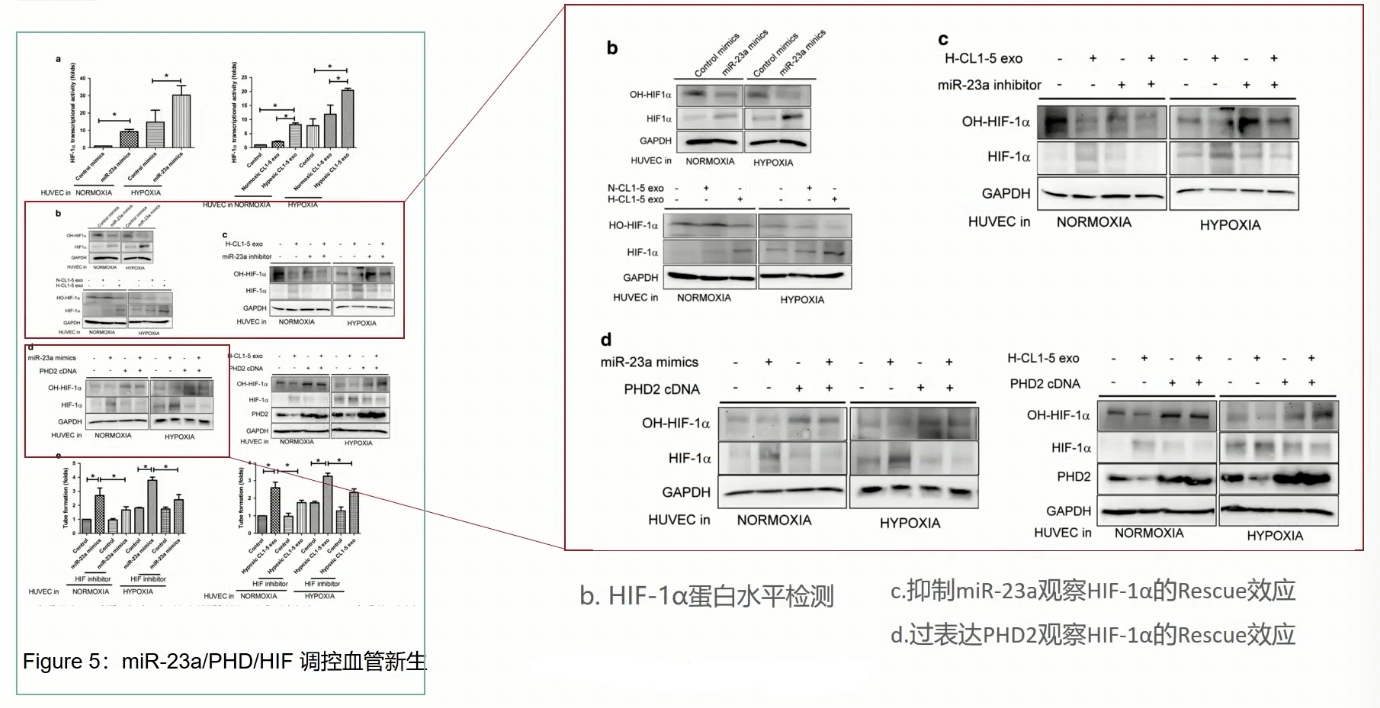
- 在背景介绍中,我们已经知道,PHD在有氧气的参与下可以介导HIF-1ɑ发生羟基化,羟基化的HIF-1ɑ会被泛素化降解,由于miR-23a可以抑制PHD1/2的功能,所以我们可以推论,miR-23a通过对PHD1/2的负调控,间接正调控HIF-1ɑ的功能。
- 在Fig.5b中,无论是使用miR-23a的mimics,和让HUVEC与缺氧诱导的外泌体孵育,都能显著降低羟基化的HIF-1ɑ,升高总的HIF-1ɑ的表达水平,而且miR-23a对HIF-1ɑ的调控是依赖于PHD1/2的,因为在Fig.5c-d中,无论是通过使用miR-23a的抑制剂,还是通过过表达PHD2的cDNA,在阻断了miR-23a-PHD1/2信号轴后,都能抑制HIF-1ɑ羟基化表达水平的降低,也能抑制HIF-1ɑ总蛋白水平的升高。
- Fig.5a,在HUVEC内,miR-23a-PHD1/2信号轴激活之后,HIF-1ɑ的总蛋白表达水平升高,这些HIF-1ɑ调控下游转录的能力得到强化,通过Luciferase证实,无论是在常氧条件下,还是在缺氧条件下,HUVEC内miR-23a表达升高之后,都可以导致HIF-1ɑ的转录能力显著提升
- 最终,在Fig.5e中,研究者通过tube formation实验证实,miR-23a激活条件下,HUVEC细胞的血管新生能力提升,而且这种提升依赖于HIF-1ɑ,因为在HIF-1ɑ抑制剂处理后,即使激活HUVEC内的miR-23a,也不能影响HUVEC的血管新生能力
- 由此,机制可以进一步细化为:内皮细胞在吞噬肿瘤来源的外泌体之后,HUVEC细胞内miR-23a-PHD1/2-HIF-1ɑ信号轴被激活,最终导致HUVEC细胞血管新生能力的提升
Fig.6
- 但是,我们注意到,在HUVEC细胞内,miR-23a-PHD1/2-HIF-1ɑ信号通路只影响细胞的血管新生能力,不影响内皮细胞与细胞之间间隙的增大,因此,miR-23a下游应该有其他效应分子,影响了内皮细胞与细胞之间间隙增大的效应。
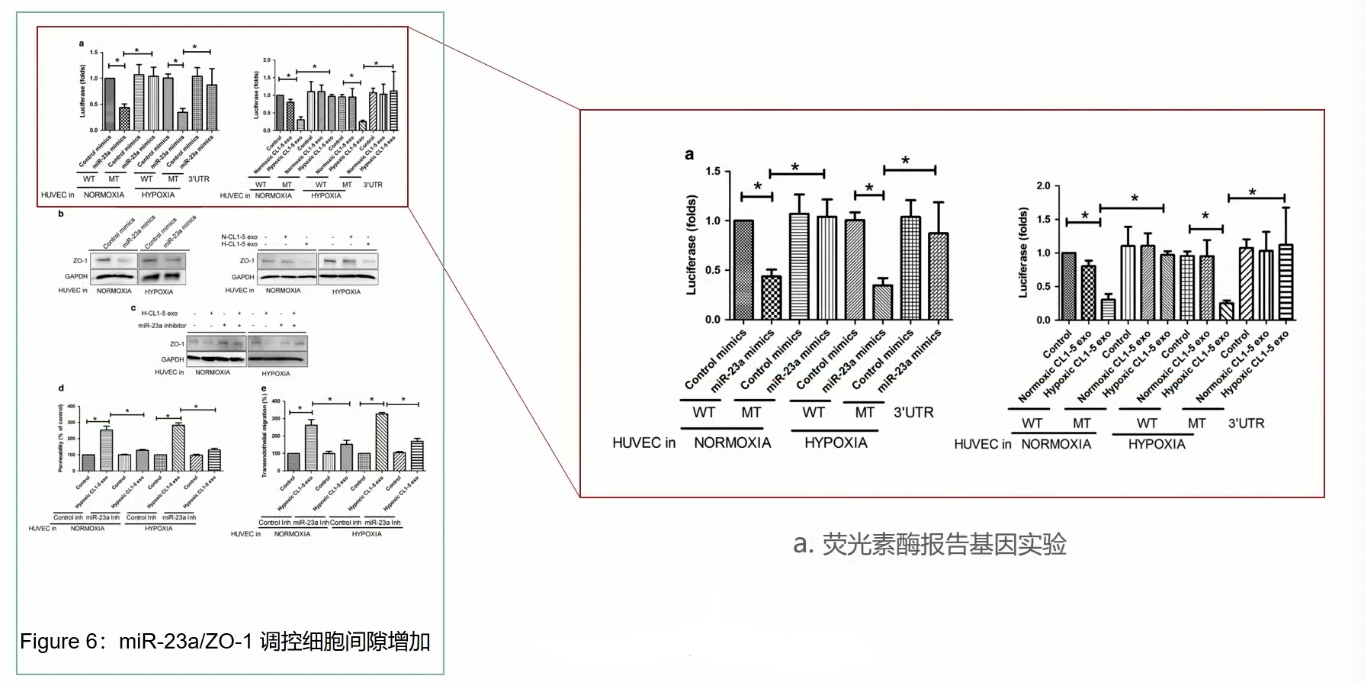
- 由于缺氧诱导的外泌体能导致内皮细胞通透性升高,而且促进了肿瘤细胞发生跨内皮细胞迁移现象,因此研究者聚焦于紧密链接,研究miR-23a是否可以直接靶向ZO-1
- 首先通过Luciferase,可以证明miR-23a可以显著抑制ZO-1的表达水平,如果把ZO-1的mRNA 3’-UTR区域与miR-23a结合的关键区域突变掉,那么miR-23a就不能再抑制突变后的ZO-1表达了,说明miR-23a可以通过结合ZO-1的mRNA的3’-UTR,抑制ZO-1的表达
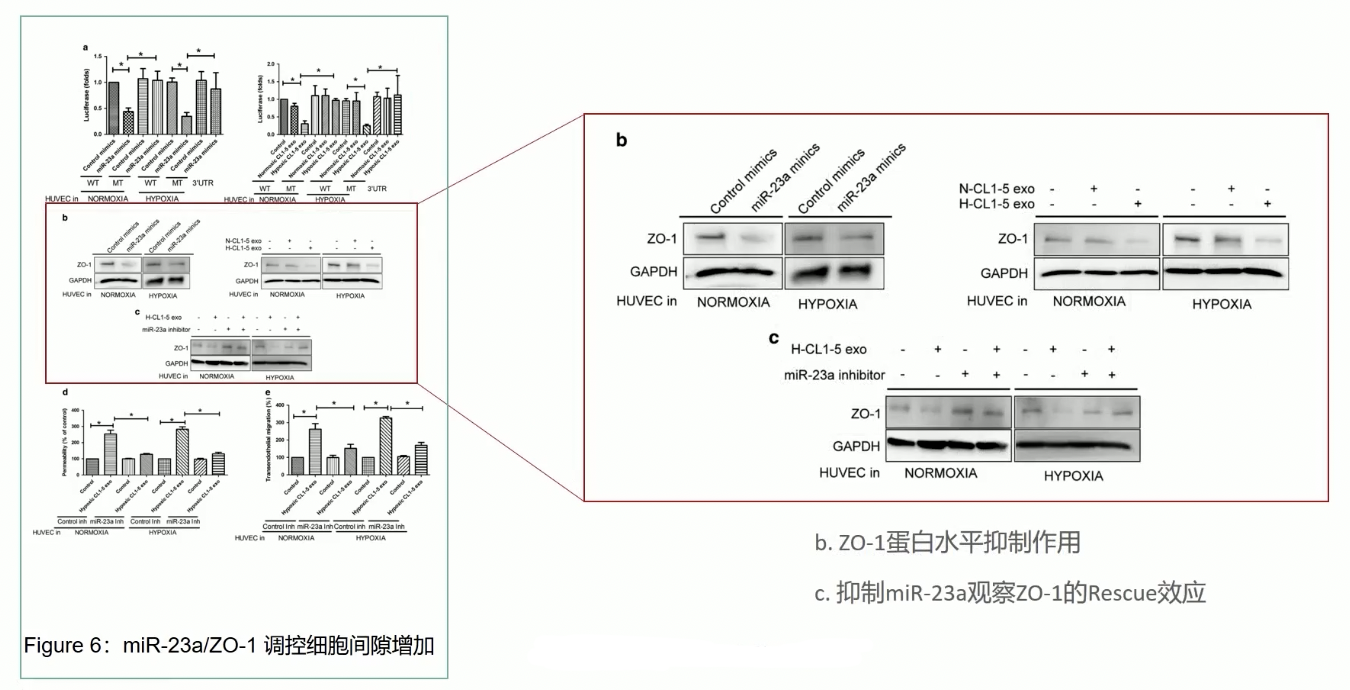
- Fig.6b通过WB,证实HUVEC细胞内miR-23a表达升高后,ZO-1蛋白表达水平显著受到抑制,这个结果和Luciferase的结果是一致的
- Fig.6c:ZO-1的表达降低是依赖于miR-23a的,因为如果通过抑制剂miR-23a,那ZO-1的表达就不再收到影响了,变得和对照一样
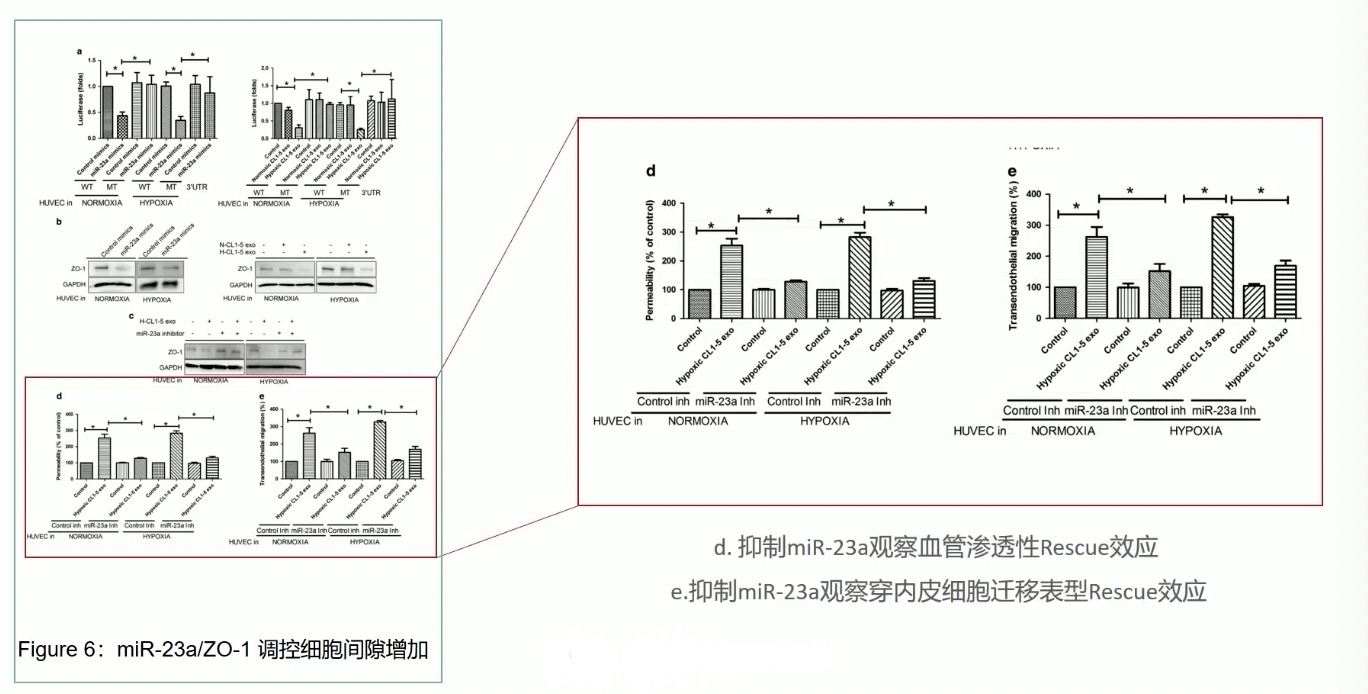
- 最后,通过HUVEC的通透性实验和肿瘤细胞的跨内皮迁移实验,证实缺氧诱导的外泌体能显著提升HUVEC的通透性和肿瘤细胞的跨内皮迁移能力,而且这个过程是依赖于miR-23a的,如果通过抑制剂抑制了miR-23a的功能,那么即使HUVEC和缺氧诱导的外泌体共孵育之后,HUVEC的通透性和肿瘤细胞的跨内皮迁移能力也不会有显著的变化
机制图
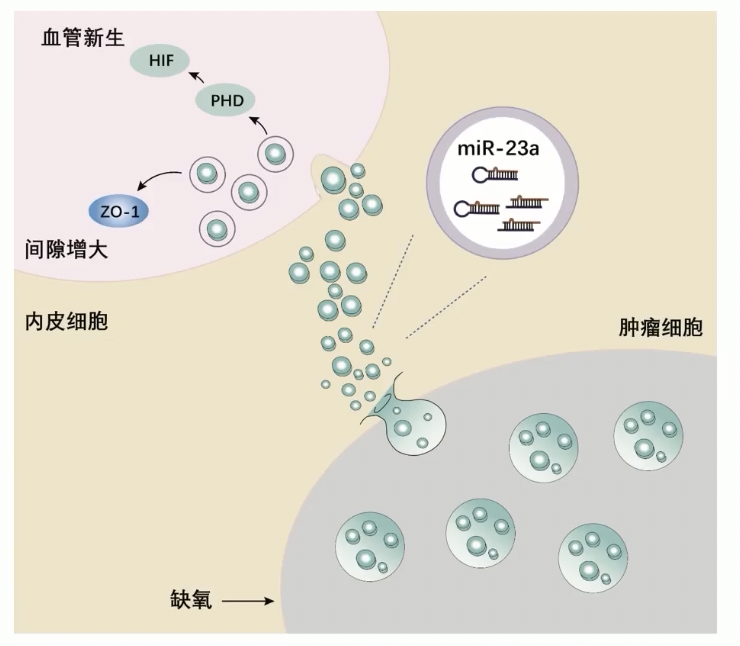
Fig.7
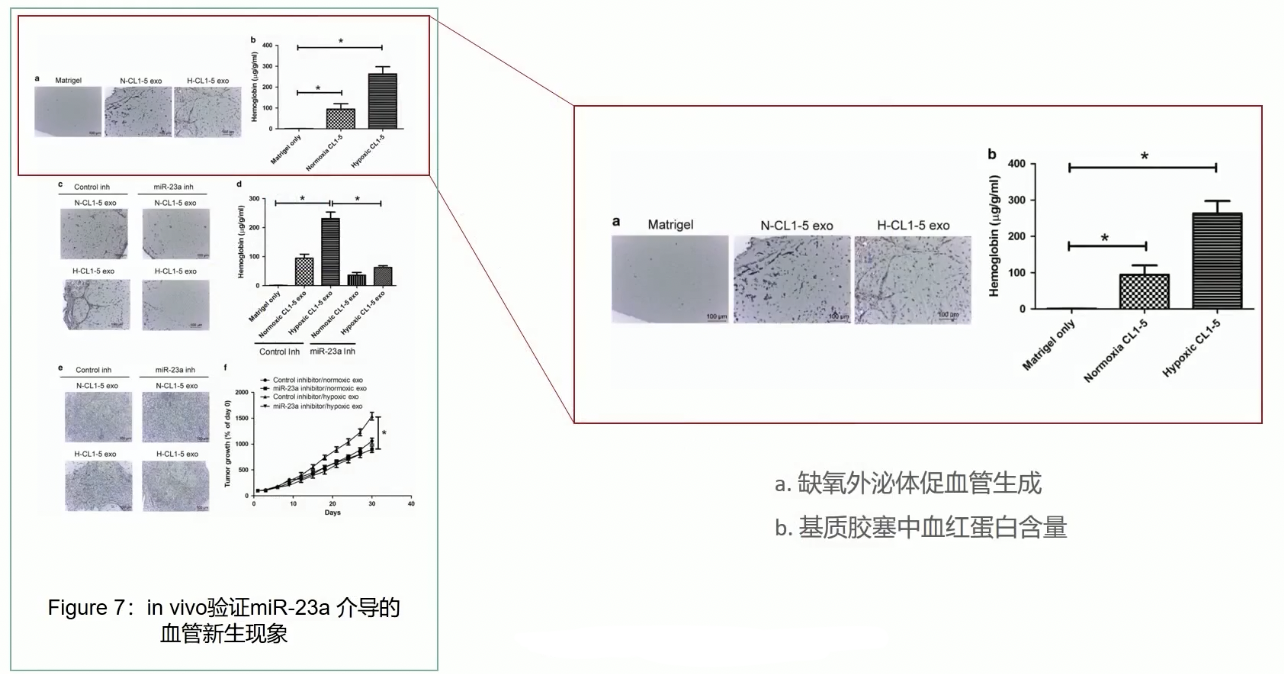
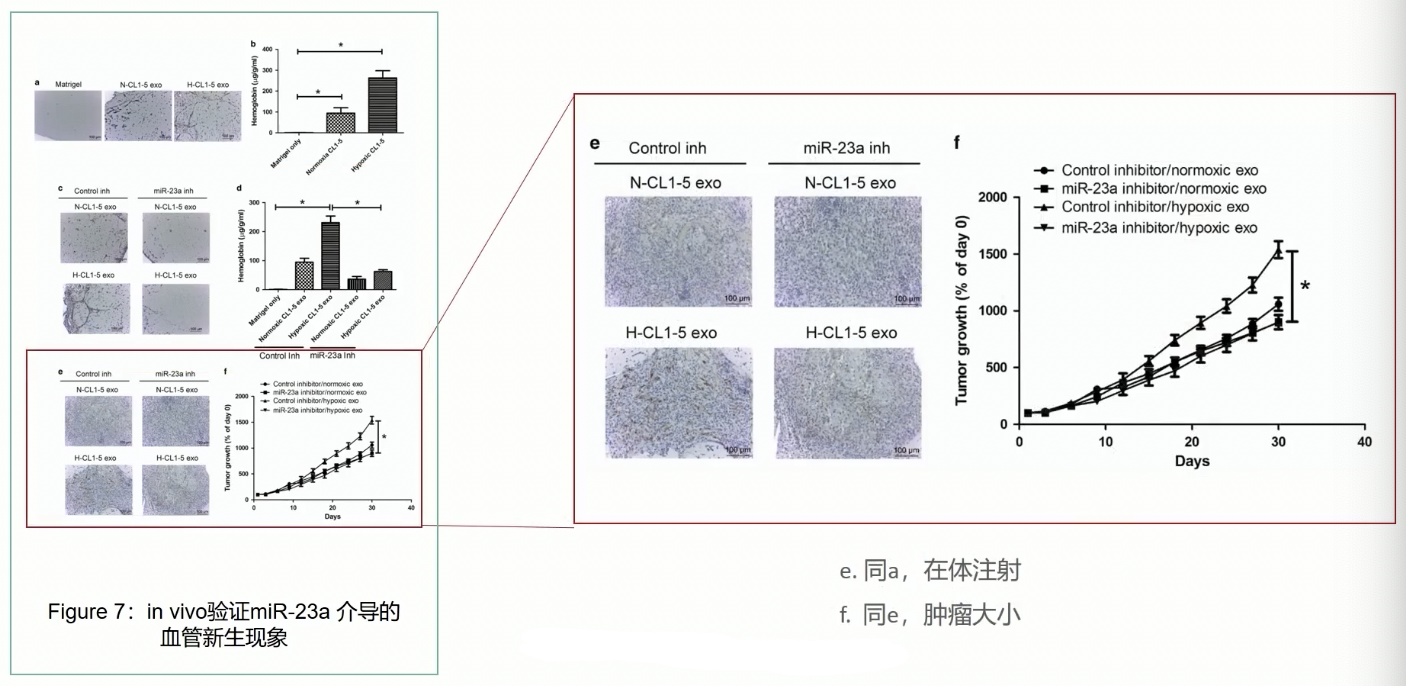
- 为了验证miR-23a的在体功能,研究人员采用了Matrigel胶栓血管生成实验,这个实验的大体流程:
- 首先将外泌体和可用于活体注射的染料以及Matrigel混合,然后注射到小鼠皮下,小鼠饲养13d后取出Matrigel胶栓,通过检测胶栓内血红素的量来检测血管的生成情况
- 实验结果显示,相对于对照胶栓,加入了常氧诱导的外泌体的胶栓中能形成更多微血管,如果加入了缺氧诱导的外泌体,胶栓内形成的血管会更多
- 如果在加入外泌体的同时加入了miR-23sa的抑制剂,那么无论是常氧诱导的外泌体,还是缺氧诱导的外泌体,它们促进胶栓内微血管形成的能力都被miR-23a的抑制剂所阻断,因此外泌体通过miR-23a介导了胶栓内微血管的形成。
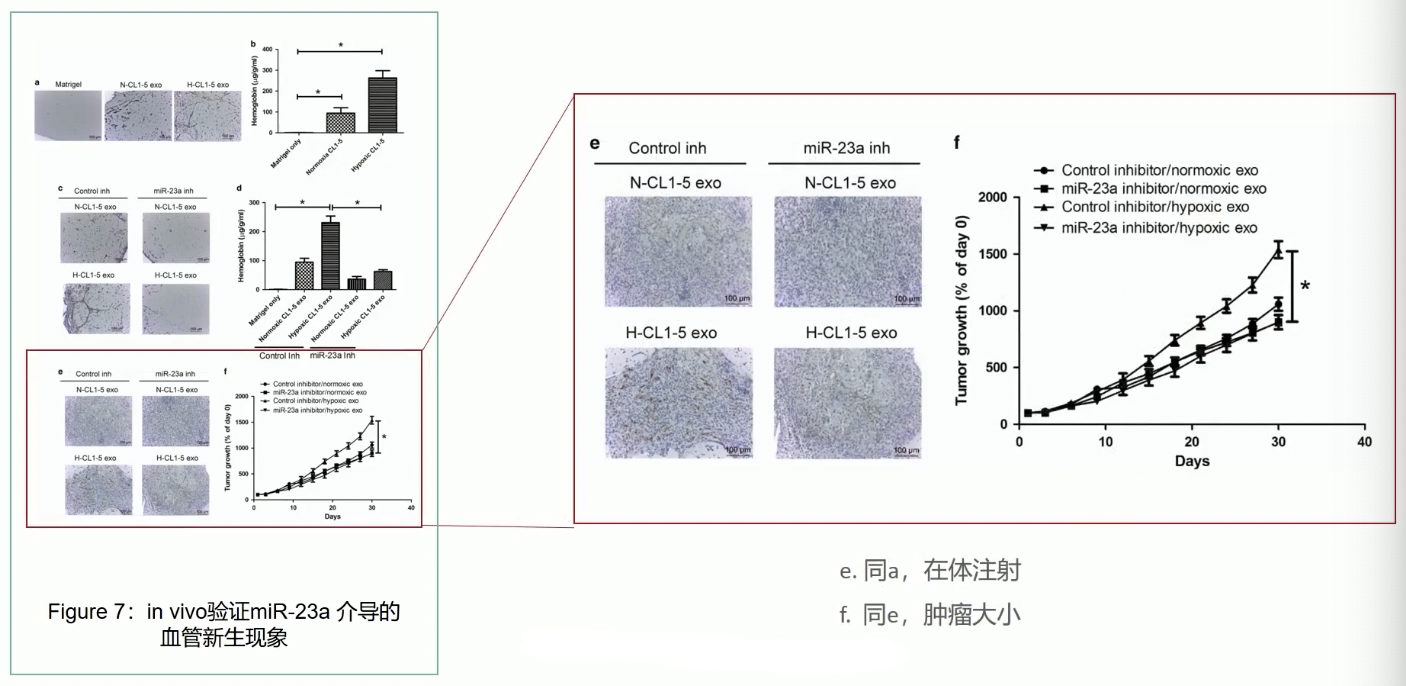
- 最后,研究者通过移植瘤的模型,验证了miR-23a的在体功能,首先将肿瘤细胞皮下接种到裸鼠体内,等移植瘤长大到50mm^3 的体积之后,再将miR-23a的抑制剂注射到组织内部,最后检测不同处理条件下移植瘤的大小变化
- 实验结果显示,相对于常氧诱导的外泌体,接受缺氧诱导外泌体移植瘤组织注射的小鼠体内获得的移植瘤体积显著增加,而且这种效应是依赖于miR-23a的,因为如果加入了miR-23a的抑制剂,这种缺氧诱导的外泌体促进移植瘤生长的效应就被抑制了。
Fig.8
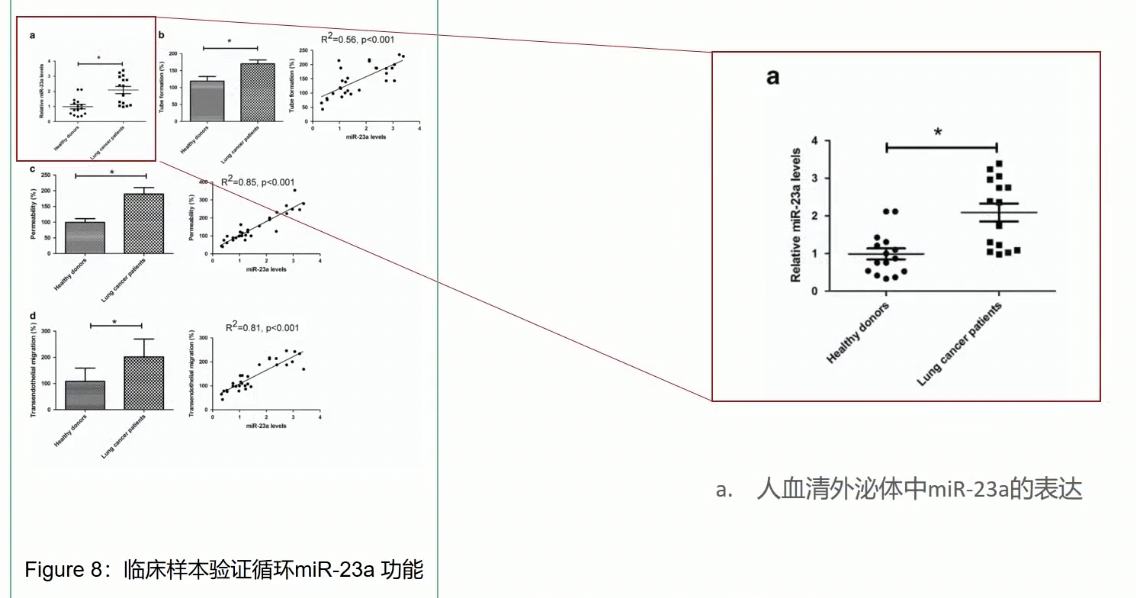
- 研究人员检测了临床样本中miR-23a的结果,首先研究人员分离了健康人和肺癌患者的血浆外泌体,然后通过定量PCR,发现肺癌患者的血浆外泌体中,miR-23a的表达水平显著高于健康人
- 将来源于健康人的外泌体和来自于肺癌患者的外泌体与HUVEC孵育,随后分别检测HUVEC的管状形成能力,以及HUVEC细胞的通透性,结果证实肿瘤患者来源的外泌体能显著促进HUVEC的管状形成能力和通透性,而且肿瘤患者中miR-23a的含量越高,这种促进能力就越强,因此miR-23a和这两种能力之间有显著的正相关性
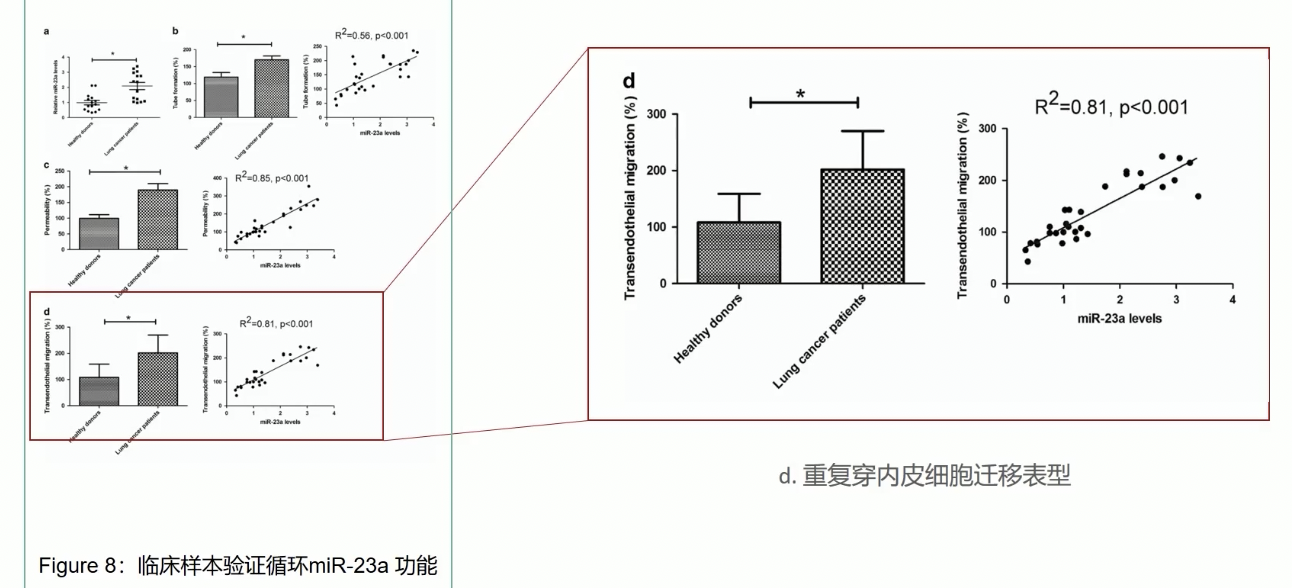
- HUVEC在接受肿瘤患者来源的外泌体孵育之后,肿瘤细胞穿越HUVEC,形成跨内皮细胞迁移的能力也显著增强了,而且miR-23a的表达水平和肿瘤细胞的迁移能力通常具有显著的正相关性






















