使用的文献:Hypoxic lung cancer-secreted exosomal miR-23a increased angiogenesis and vascular permeability by targeting prolyl hydroxylase and tight junction protein ZO-1

- 各位解螺旋的小伙伴大家好,我是馒头今天我们进入到转移相关的实验详解。
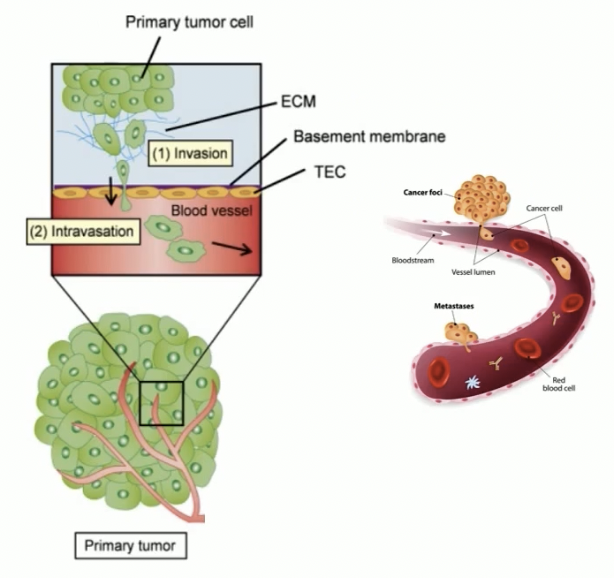
- 我们通常将肿瘤体内转移过程简单地分为以下几个步骤:即局部侵润,渗入血管、随血液循环系统转移并在其中存活、移出血管,在新的部位定居并增殖。
- 在体外,为了模拟这些过程,这篇文章的作者是通过细胞迁移,跨内皮迁移和内皮细胞通透性来完成的,这也是在体外研究肿瘤转移常用的几个实验方法。
细胞迁移实验
划痕法
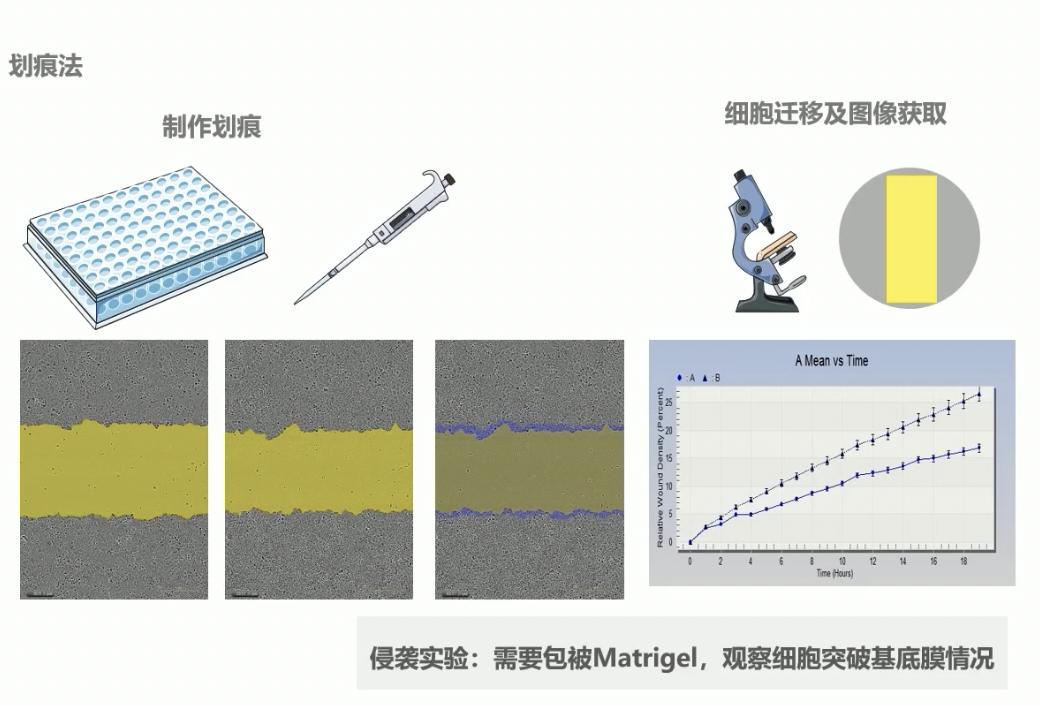
- 细胞划痕实验是一种操作简单、经济实惠的,研究细胞迁移或肿瘤侵袭的方法;这个方法的原理是:当细胞长到融合成单层状态时,我们在融合的单层细胞上人为地制造空白区域,划痕边缘的细胞会逐渐进入空白区域,使划痕愈合,一般的步骤分为制作划痕、细胞迁移及图像获取,以及后续的数据处理。
- 我们来说一下划痕的操作:最传统的划痕说起来比较简单,只需要一把室、一支记号笔和20μL的枪头,一块接种满细胞的六孔板;如果我们想要获得一样宽度的划痕,获得尽量漂亮的图像,也是需要练习的。
- 具体的实验过程:一般的方法是先给六孔板划出均匀的横线,再接种好细胞,在细胞划痕的当天,要达到100%以上的融合度,要达到铺满的状态。划痕时,我们用枪头比着室子,垂直于记号笔划过横线,垂直枪头划过细胞,最后PBS洗去悬浮的细胞,分不同的时间点对交叉点进行观察和记录。
- 传统划痕实验的注意事项:
- 采用无血清或低血清的培养基:我们在做划痕实验时,要选用无血清或低血清浓度的培养基,否则,细胞的增殖就不能被忽略
- 适用的细胞:使用划痕的方法进行迁移实验时,最好是上皮样细胞,细胞本身迁移能力强又具有极性,相对能耐受无血清的培养,而大多数的肿瘤细胞是无法耐受无血清培养的。如果加入血清培养的话,迁移实验实际上反映的是细胞迁移和细胞增殖共同作用的结果
- 也可以采用划痕的方式做肿瘤细胞的侵袭实验,但是,要铺上一层我们前面说过的基质胶Matrigel,观察细胞突破基底膜的情况。
- 为了解决前后观察位置不固定的问题,一般都是选择与孔板背后记号笔划的交叉点进行观察。
- 除了六孔板以外,我们也可以采用十二孔板甚至是九十六孔板来做划痕实验
- 最后,让我们再来看一下下面这四幅图,这四幅图是采用动态成像的方式进行观察的,也就是分时段连续拍照的方式,采集图像进行结果的分析。
transwell小室
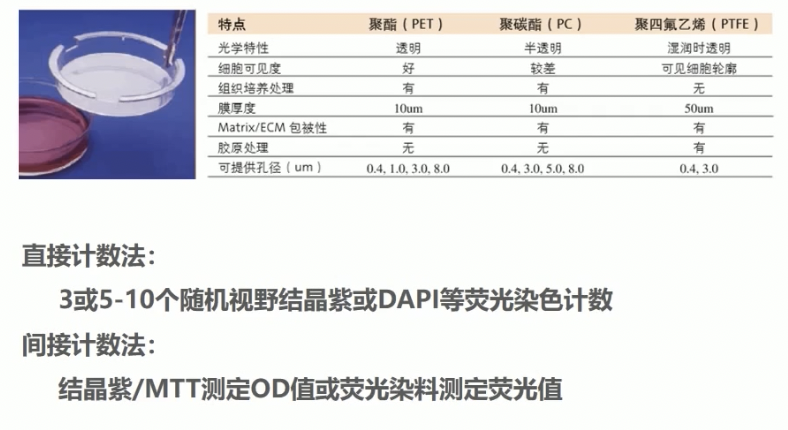
- transwell小室是可放置在孔板里的小杯子,无论是什么形状,关键的部分都是一致的,就是杯子底层有一张通透性的膜,这层膜是有微孔的,孔径大小从0.1到12微米不等,不同实验对小室的孔径要求也不一样,小于3微米孔径的小室,细胞不会迁移通过,当研究不涉及细胞运动能力,不需要细胞穿过膜时,可以选择3微米以下孔径的PC膜。
- 在这里,我们要介绍的迁移实验,要选择8或者12微米膜的小室,这样上室细胞可以穿透膜进入到下室,通过计数进入下室细胞的数量,可反映细胞区划迁移和倾袭的能力。
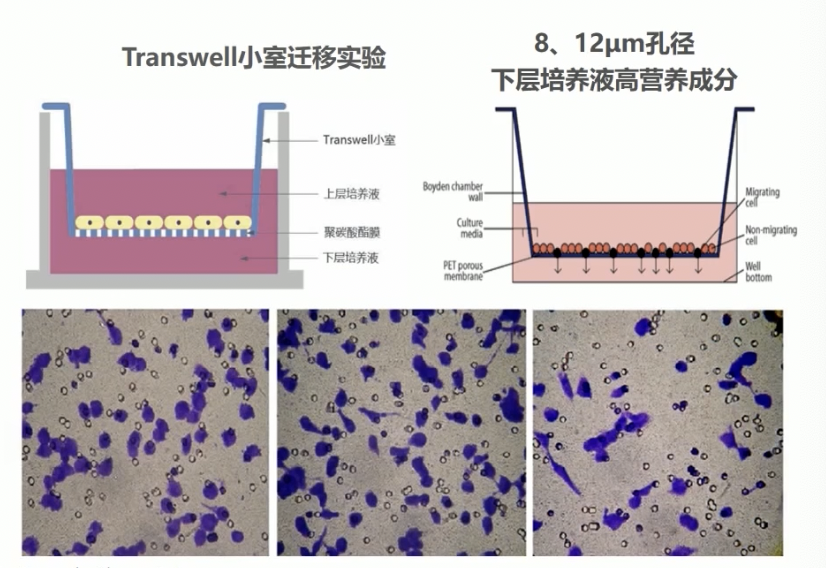
- transwell小室基本原理是将它放入培养板中,小室内称为上室,培养板内称为下室,在上室内添加上层培养液,下室内添加下层培养液;上下层培养液以膜相隔,将细胞种在上室内,由于膜具有通透性,下层培养液中的成分可以影响到上室内的细胞,从而可以研究下层培养液中的成分对细胞生长运动的影响。
- 具体的实验方法:细胞接种前,血清饥饿12小时,常规消化,离心,收集细胞,用低血清DMEM培养液,旋成单细胞旋液;常用的24孔培养板上室内加入200μL细胞旋液,下室内加入500μL含有10%血清的DMEM培养液培养24小时后,PBS清洗两次,用棉球小心擦去上室内未迁移的细胞,4%多聚甲醛固定20分钟,甲醛通透细胞20分钟,PBS洗两次,用0.1%的结晶紫染色30分钟,PBS再清洗两次后,去除多余染料,显微镜下观察拍照。
- 计数方法有两种:
- 直接计数的方法,可以使用吉姆萨染色,也可以使用结晶紫染色,推荐使用0.1%的结晶紫染色计数细胞后,还可以使用33%的醋酸进行脱色,使结晶紫完全洗脱,洗脱液可以在570纳米的酶标仪上检测OD值,间接的反应细胞数,尤其是当穿过的细胞数量非常多,不易计数的细胞;如果是非贴壁细胞,细胞透过膜不能附着而掉入到下层消失,可以收集下层培养液,采用流式或者直接计数,甚至是MTT的方法进行计数。
- 间接计数的方法:介绍直接计数时也有提过,当细胞穿过膜或者非贴壁细胞的时候,我们可以采用结晶紫溶解或者是MTT,或者是荧光染色等等的方法
- 一些值得我们注意的问题
- 细胞量:一般是5万个细胞,但具体的密度需要自己摸索,不同的细胞迁移能力不同,细胞的量如果过多,穿过膜的细胞就会过多过快;繁殖量少,还没有到检测点细胞已经全部透过膜,所以最少也得保证在收样时,上室内还有一定量的细胞存在。
- 气泡:下层培养液和小室之间会有气泡产生,一旦产生气泡,下层培养液的趋化作用就会消失或者减弱,所以我们在种板时要小心,一旦出现气泡,要把小室提起,去除气泡后再把小室放入。
- 时间:常规处理12到48小时不等,时间点要根据自己的实验因素去设置。
这篇文章中作者所用到的方法
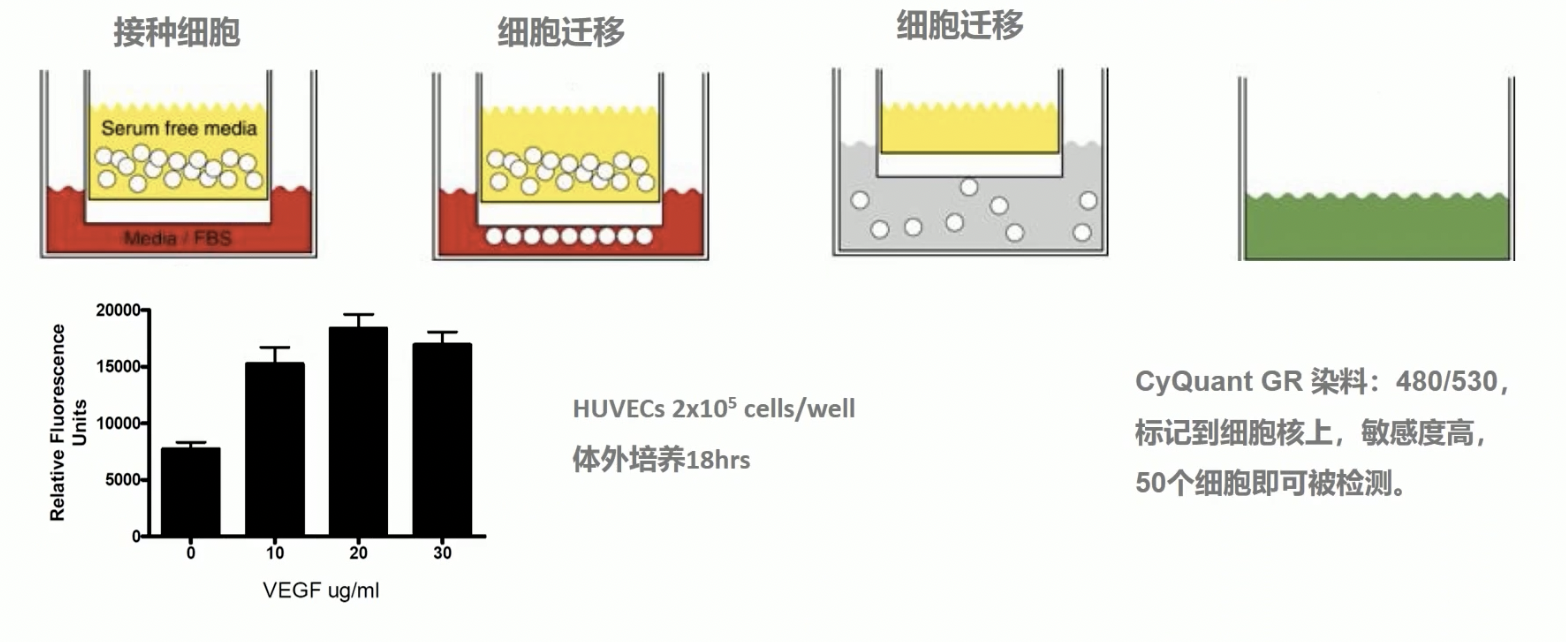

- 作者所用到的方法,也是基于transwell小室的原理,是米里博的产品,与普通的transwell小室的方法检测迁移不同的是
- 采用三微米孔径的膜,更适合内皮细胞的迁移实验
- 预包备了纤维连接蛋白,适合于细胞的迁移与粘附,且预包备好,省去了自己包备的时间
- 采用荧光染色的方式,敏感性高,500个细胞即可被染色到
具体的方法:与transwell小室相同,也是先接种细胞,12到48小时细胞迁移,采用试剂盒里的acutase分散酶消化细胞,使细胞从膜上进入到缓冲液中,最后裂解细胞,荧光染料染色,检测荧光值;采用荧光值的大小,反映迁移细胞的数量,具体的步骤,小伙伴们可以根据货号去米里博的网站进行查找
跨内皮迁移实验
- 肿瘤细胞的跨内皮迁移是肿瘤侵袭和转移过程中重要的一步,肿瘤细胞从原发部位通过跨越血管内皮层,迁移到其他实质组织内大量增殖,形成次级瘤组织。
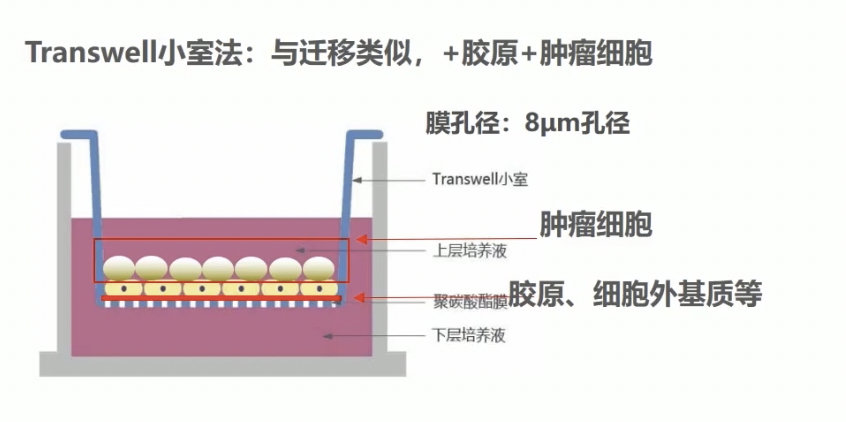
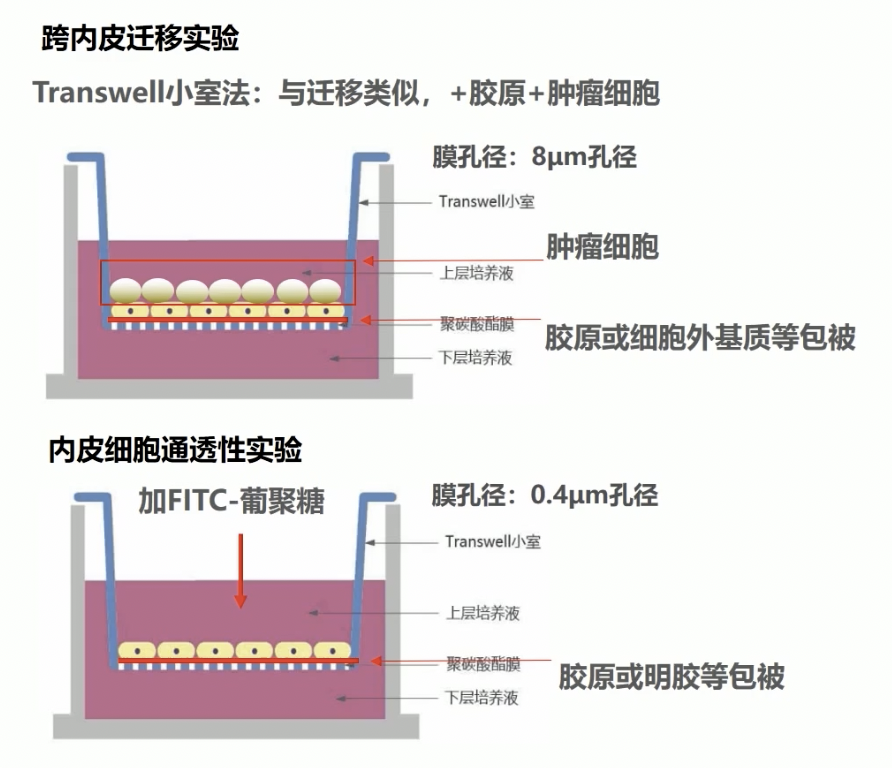
- 在体外,也是通过transwell小室的方式模拟肿瘤细胞这一迁移过程,这个实验与迁移类似,采用的膜孔径是8微米,膜上需要铺上胶原或者基质胶Matrigel等模拟细胞外基质,最后将肿瘤细胞接种于上室内,在一定时间内观察跨过内皮细胞的能力。
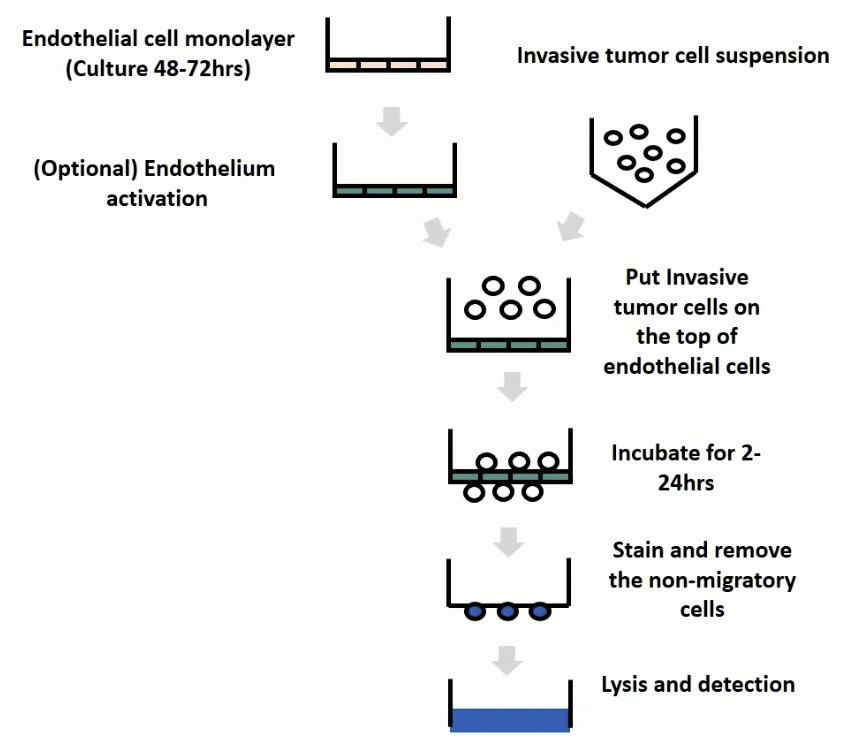
- 我们先看上图,上图描述了整个跨内皮迁移的实验流程,具体的过程是:
- 首先将内皮细胞以高密度接种于孔径是8微米的transwell小室内,在这里的transwell小室可以是被胶原或者细胞外基质包备的
- 接种过夜后去除未贴壁的细胞,观察内皮细胞的融合度大于95%,我们再接种肿瘤细胞。
- 观察2到24小时以后,观察跨过内皮细胞迁移到下室的肿瘤细胞,检测方法与迁移类似,小伙伴们可以参考迁移的检测方式。
上图是文中使用的试剂盒,这里列举了比色的试剂盒,当然也有迁移试验类似的荧光检测试剂盒。
内皮细胞通透性实验
- 在这里我们还是介绍采用transwell小室的方式,有条件的小伙伴也可以考虑采用测定跨膜电阻值的方式。
- 与前面两个实验不同,这里我们选择的是0.4微米的膜,可选择Ⅰ型胶原包备,加入大分子量有FITC标记的葡聚糖,通过对透过性的有FITC标记的葡聚糖进行检测评价内皮细胞的透过性。
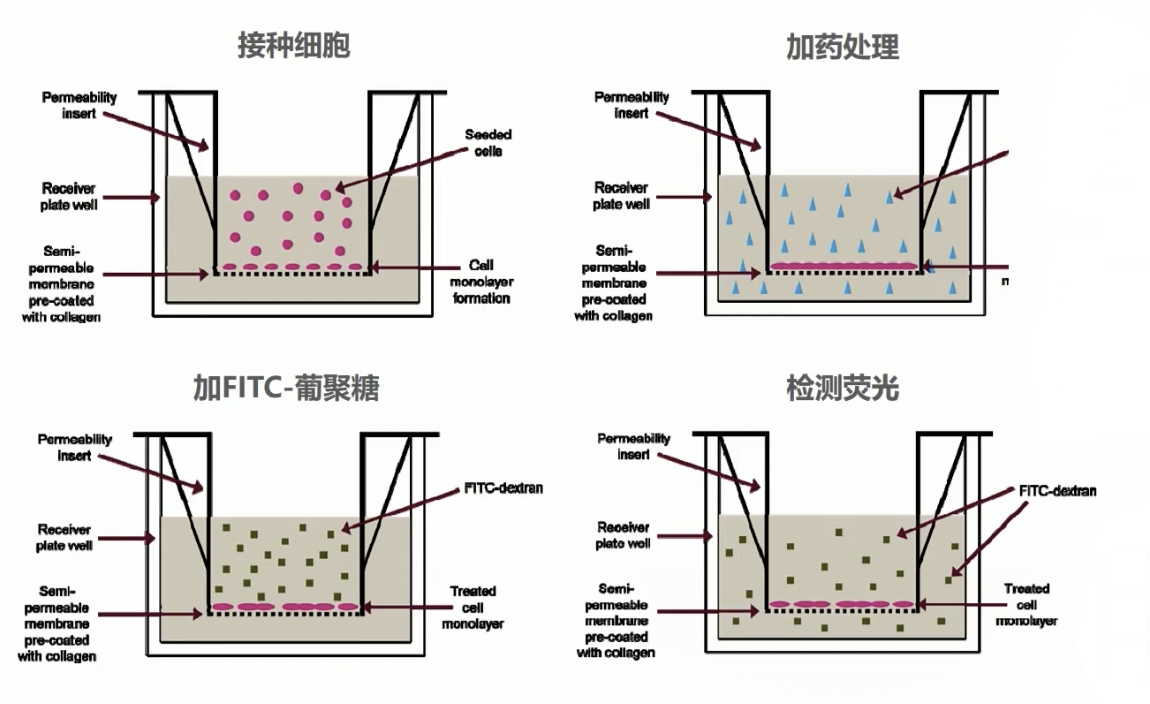
- 上图是通透性实验的基本流程,首先是接种内皮细胞,细胞长满后加药处理,处理一段时间后加入FITC标记的葡聚糖,室温闭光孵育20分钟后进行荧光值的检测具体的方法可以参考米里博网站的说明书
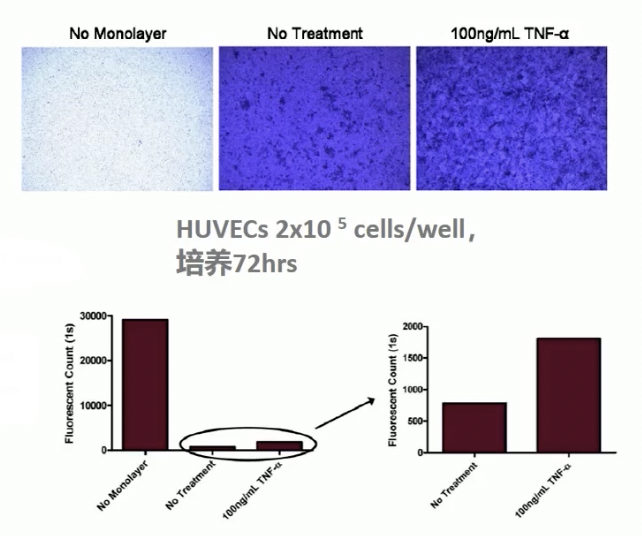
- 上图是说明书里对试剂盒实验的演示,其中NO monolayer代表未接种细胞,NO treatment代表未给予处理,采用TNR-α处理后细胞通透性增加,主要体现在对膜上细胞进行染色,着色的地方变多,对荧光值进行检测荧光值变高。
















