- 在接下来的两讲内容中,我们将围绕着内皮细胞相关的实验及技术进行讲解。
肿瘤血管新生背景复习
- 可以参考这节课的内容
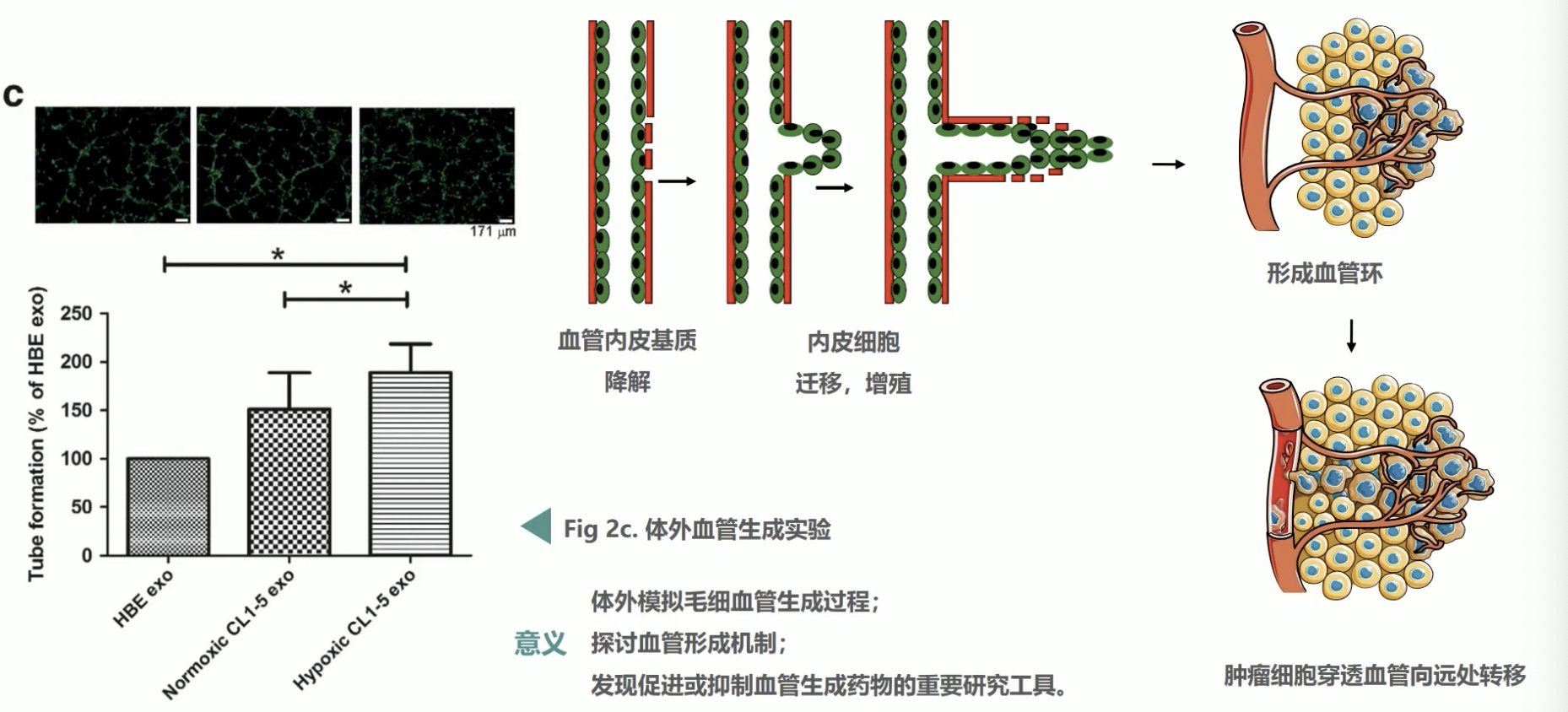
- 肿瘤血管的生成是极其复杂的过程,一般包括血管内皮基质降解、内皮细胞移行、增殖、内皮细胞管道化分支形成血管环、形成新的基底膜等等步骤。由于肿瘤组织新生血管结构及功能的异常,且血管基质的不完善,微血管容易发生渗漏,因此肿瘤细胞不需要经过复杂的侵袭过程就能直接穿透血管,进入到血流并向远处的部位形成转移。
- 越来越多的研究表明,良性肿瘤血管生成稀少,血管生长缓慢,而大多数的恶性肿瘤血管生成密集且生长迅速,因此血管生成在肿瘤发生转移过程中起着非常重要的作用,抑制这一过程就能够明显地抑制肿瘤组织的发展和扩散。
- 体外的血管生成实验能够很好的模拟肿瘤血管发生过程,探讨血管发生的机制,是发现促进或抑制血管生成药物的重要研究工具。
血管生成实验的材料和基本的步骤
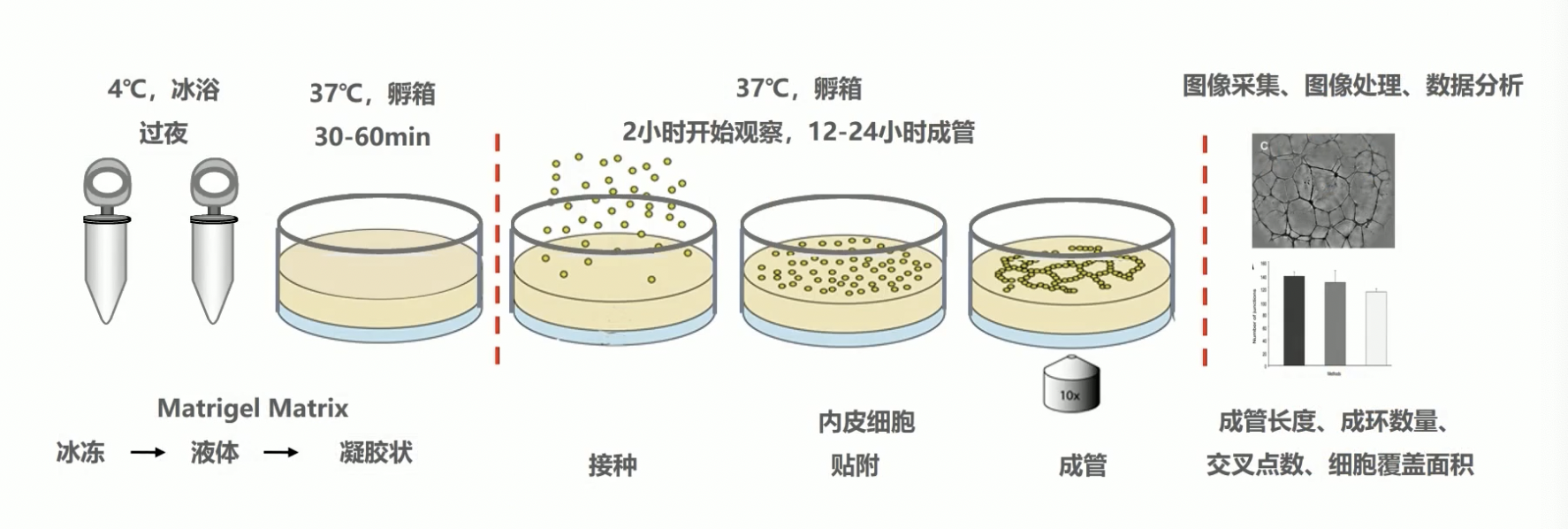
- 材料主要是内皮细胞和基质胶,步骤我们在这里把它分为三个部分:
制备基质胶
- 首先是制胶,关于基质胶的注意事项会在下一张ppt中进行比较详细的介绍。
- 我们在这里首先要将分装好的基质胶化冻,采用的是4°C冰浴过夜的方式,化好的基质胶呈液体状,再使用提前预冷好的枪头将液体状的基质胶铺在孔板中,一般是96孔板孔每个孔铺50微升的基质胶。
- 基质胶可以按照1比1的比例稀释,也可以直接使用原液,需要大家的预实验看胶的凝固效果。
- 最后我们将孔板放入到37度的孵箱内,孵育30到60分钟,等待胶凝固后,这样我们的第一步就完成了。
接种细胞
- 接种细胞,一般是2万到3万个细胞,这也是需要我们设置细胞梯度摸索浓度的。
- 成管的时间与细胞浓度相关,一般2到6h就会有成管现象,整个观察时间一般不会超过24h,24h后形成的血管环有可能出现崩解。
图像的采集处理和分析
- 倒置显微镜下采集图像,使用ImageJ或者IPP分析图像
- 主要的记录指标有成管长度,成环数量,交叉点数,以及细胞覆盖面积。
实验的注意事项
Matrigel基质胶

- 基质胶最早是BD的产品,这两年被康宁收购了。基质胶是BD采用专利技术,从富含胞外基质蛋白的EHS小鼠肿瘤中分离出来的。主要的成分由层粘连蛋白、Ⅳ型胶原、潮蛋白、硫酸肝素糖蛋白等组成,还包含了生长因子和基质金属蛋白酶等等。
- 每个批次的基质胶的浓度都不同,当我们的实验要根据基质胶的浓度进行配置时,我们要根据批次号查询一下该批次基质胶的浓度。
- 商品化的基质胶有不同的配方,除了最基本的配方以外,也有经过不同处理的,类似于有低生长因子的、有去除酚红的、也有的专门高浓度的基质胶。
- 在成管实验中,如果我们后续还要对细胞进行荧光染色、观察成管情况的话,建议选择去除酚红的、可以有效的减低背景。当我们要看药物处理对成管现象的影响的时候,也要选择低生长因子的基质胶。
- 另外,基质胶在室温或37°C时会很快凝固,因此,我们在分装基质胶时,一定要注意把枪头、分装管预冷,而且也要在冰上进行分装。分装后,尽快放入-20°C或-80°C的冰箱里。
- 做成管实验铺胶时,要使用无血清的基础培养剂对基质胶进行稀释,最多的稀释比例不能超过2倍,稀释太多会不成管,影响实验。
- 铺胶的手法需要训练,胶面不平,混入气泡,都会影响我们的拍照效果。在这里分享一下,我们可以选择24孔板进行铺胶,效果稍微会好一些。
- 做成管实验时,选用的耗材一般会选择比较一般的细胞培养板,如果实验室经费预算充足的话,推荐使用德国的ibidi,采用这个方法可以减少基质胶的用量,也可以防止使用孔板铺胶时不可避免的凹液面。
内皮细胞
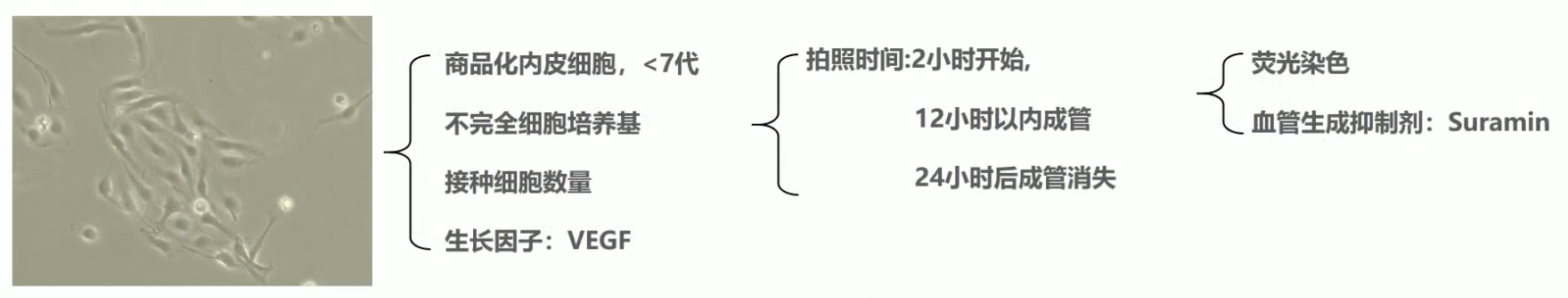
- 在做血管生成实验时,我们第二个要注意的是内皮细胞。
- 我们选择的内皮细胞可以是自己分的奇静脉内皮细胞,也可以是买的商品化内皮细胞。细胞要选择7代以内的,最好是使用3-5代的细胞最为合适。
- 一般培养内皮细胞时,我们会用专用的内皮细胞培养基,或者是自己添加细胞因子配置的。在这里我分享一种内皮细胞的培养方式,小伙伴们可以参考一下。基础培养基选择的是M199,加入10%的FBS,再加入1纳克每毫升的内皮细胞生长添加物,再加入10个单位每毫升的肝素,还有1.25微克每毫升的胸苷。采用这个方法培养内皮细胞成本比较低,而且内皮细胞的状态维持的也比较好。
- 我们在做试验的时候要注意降低培养液中的营养成分,这样将有助于我们成管。
- 再有就是前面也提到过的细胞数量,一般会选择2万到3万个细胞为宜,需要我们进行预实验来摸索条件。
- 在做成管实验的时候,可以添加VEGF等细胞因子,将有助于我们的细胞成管。
拍照时间
- 拍照的时间点要把握好,一般在2到6h就会有成管,12h基本已经可以形成明显的管状结构,24h以后管状结构就会崩解,所以一般拍照时间不会超过24h,大部分是在12到18h以内即可完成。
- 因此我们在拍照设计时间点时一定要注意相对密集些,记录下照片。
成管后的染色
- 常用的染料有两种,一种是钙黄氯素,是亲脂性染料,可以透过细胞膜发出绿色的荧光。另外一种是DL,是一种亲脂性膜染料,进入到细胞膜后会激发出很强的红色荧光。
血管生成抑制剂,
常用的药物是苏拉明,可以抑制细胞成管。
图像的采集、处理和数据分析

- 采集的图像可以是黑白的相差图,也可以是荧光图像。如果是荧光图像,我们要将图像转化成灰度图进行分析。
- 我们要分析的指标有:成管的长度、成环的数量、交叉点数和细胞覆盖面积。
网上的付费方式
- Wimasis图像分析在线平台,是一个付费的细胞实验图像分析平台,我们只需要将细胞实验后获取的大量图像,通过简单的上传就能获得图像分析的结果。
- 这个方式的优点是,简化了繁琐的图像分析流程,而且能够得到标准化且可靠的实验图像分析数据。我们可以根据自己要分析图像的数量,选择不同的打包价格,当然,这个价格也非常不菲。
ImageJ进行图像分析
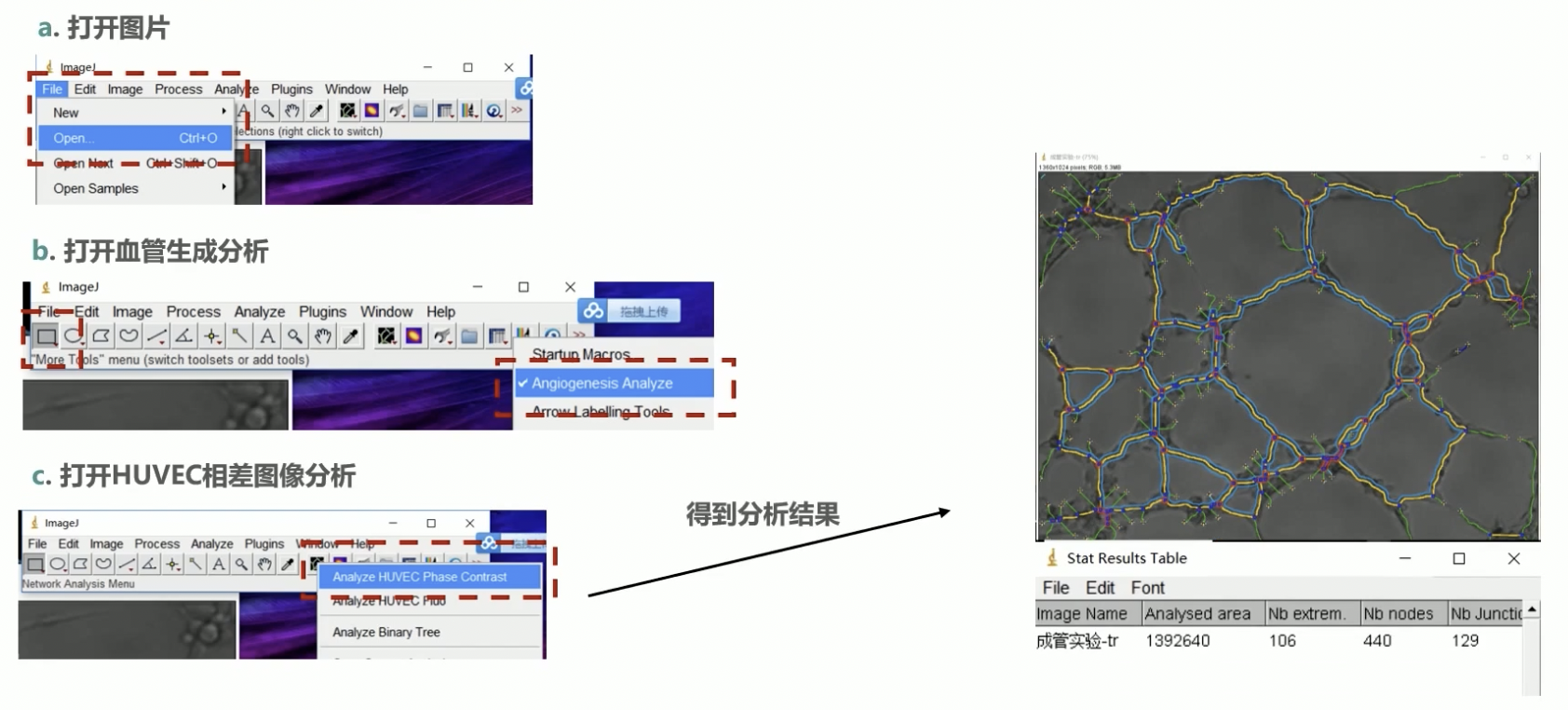
- 我们再来介绍一下比较经济的方法,采用ImageJ进行图像分析。推荐ImageJ,相对Ipp更简单一些。
- 第一步,我们先要打开分析的图片。
- 第二步,打开血管生成的分析软件。
- 第三步,我们再选择菜单栏里网格状这个选项,跳出的下拉菜单后选择奇静脉相差图像分析,等待两分钟,就会自动跳出分析好的图像和分析结果。
- 第四步,我们再将结果保存即可
图像分析结果解读
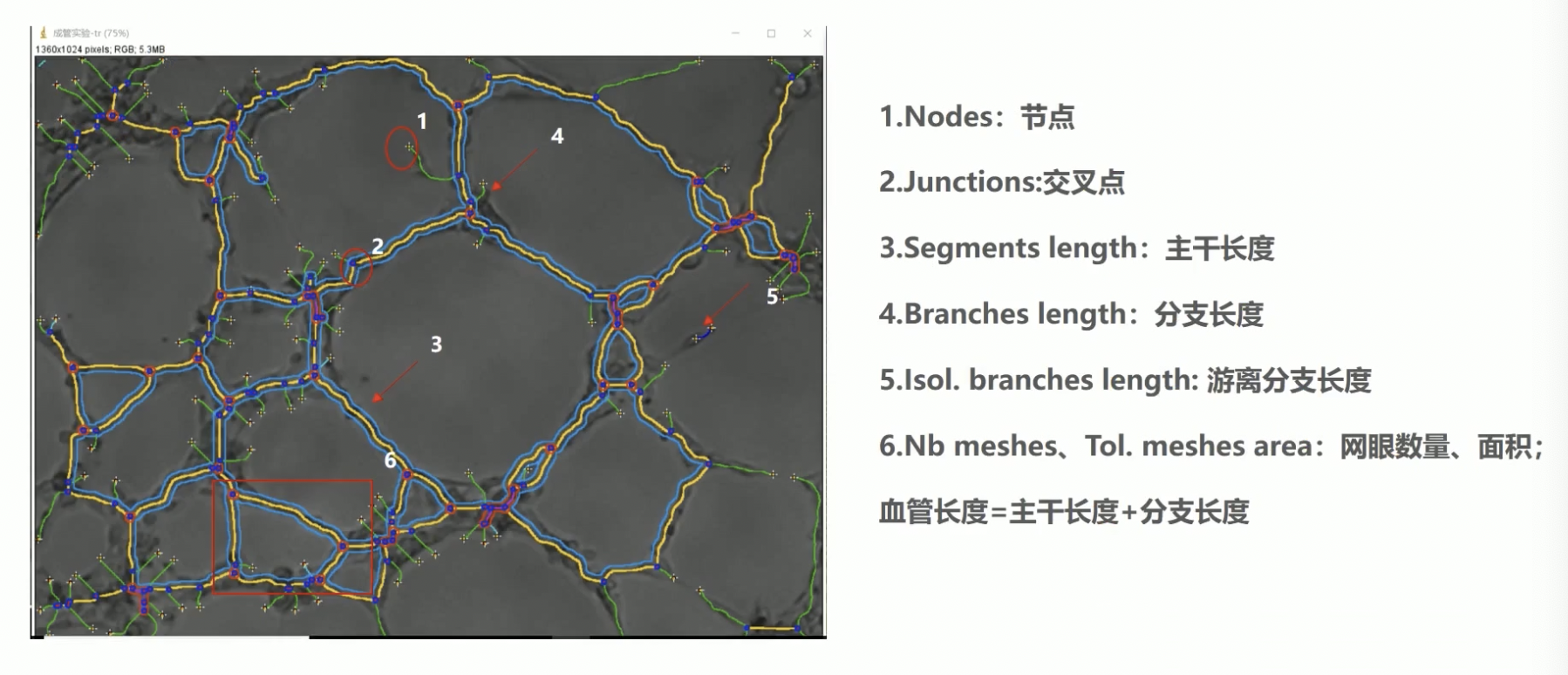
- 最后,让我们再来看图像分析的结果。我们先来弄懂这些参数的意思。
- 结合图片看,图标1是节点,也就是小叉的位置。
- 图标2是交叉点,在图中是这个红色的点,顾名思义是形成的管状交叉的点。这是我们作为统计的重要的观察指标之一,反映的是血管新生的能力。
- 图标3是主干长度,也有人会把主干长度作为成管的长度。
- 图标4是分支长度,图标5是游离分支的长度。我们要统计的成管长度一般是主干长度加上分支长度的。
- 图标6,我们圈起来的地方表示网眼,也就是成环的数量和面积。
- 在实际过程中,由于实验设计,可能很难形成像图片中比较好的血管环。这里也是介绍了相对比较基本的统计数据。我们在实际操作中要具体问题,具体分析。
- 最后,我们采用软件分析,分析的结果是像素。如果我们需要得到微米长度单位的话,是需要进行标尺校正的。



