使用的文献:Thyroid transcription factor 1 enhances cellular statin sensitivity via perturbing cholesterol metabolism

本文的研究背景
TTF-1
- 本文研究的主要分子是TTF-1,全称是Thyroid Transcription Factor 1,甲状腺转录因子1。这个分子还有另外一个名字,叫做NK2-同源盒蛋白1,NKX2-1,全称是NK2 homeobox 1。TTF-1基因是同源盒蛋白基因NK2基因家族中的一员。TTF-1基因位于14号染色体的长臂。
- 这个家族成员包含三段非常保守的序列:第一段是homeo结构域,homeo domain。第二段是TIM结构域,第三段是NK2结构域,其中最重要的结构域是homeo domain。这个结构域是介导转录因子TTF-1和DNA结合的。在文章中,研究者也通过构建缺失HD结构域的TTF-1质粒,作为没有功能的TTF-1,在研究中起到阴性对照的作用。
- 关于TTF-1的功能研究结果是有所矛盾的,因为有的研究发现,TTF-1基因在肺癌中出现拷贝数增加的情况,也就是Gene Amplification现象。这就提示TTF-1在肺癌的发生过程中,功能是被过度激活的,从而起到癌基因的功能。但是又有研究发现,TTF-1可以抑制肺腺癌的进展,这又说明TTF-1具有抑癌基因的作用。TTF-1究竟是发挥癌基因作用还是发挥抑癌基因的作用,取决于细胞内的具体环境。这也是一种环境依赖性的作用方式,所谓的Context Dependent Manner。
ABCA1
- 研究的另外一个分子是ABCA1,它的全称是ATP Binding Cassette Transcript A1,ATP结合核转运体A1。它属于ATP转运核转运体超家族,也就是ABC超家族。ABC超家族的成员,主要功能是通过消耗ATP,介导蛋白质、胆固醇、磷脂等多种物质进行跨模转运。如果大家听过24型课程中耐药相关的课程,就应该知道,由于ABC超家族成员积极参与多种物质的跨膜转运,因此ABC超家族的多个成员也都是介导耐药的关键分子之一。
- ABCA1主要负责促进胆固醇从细胞内的流出,也就是cholesterol efflux。ABCA1受到核受体超家族成员LXR,liver X receptor肝脏X受体的调控。LXR本身就是一个转录因子,在激活后LXR可以和ABCA1启动子结合,从而诱导ABCA1的表达。在本篇文章中,研究者多次采用LXR的激动剂,从而通过活化的LXR促进ABCA1的转录表达,作为研究中的阳性对照。
他汀类药物
- 作者在本篇文章中还研究了一类药物,是他汀类药物。他汀类药物是降血脂的一线药物,降脂作用明显,效果良好。他汀类药物的降脂作用机制是,竞争性抑制胆固醇合成的限速酶,羟甲基戊二酰辅酶A还原酶(HMGCR),从而减少细胞内的胆固醇水平,而且这一机制也能够调控低密度脂蛋白胆固醇受体LDL-R的水平,从而影响血液循环中低密度脂蛋白胆固醇的含量。目前他汀类药物已经成为全球应用最广泛的心血管疾病的治疗药物之一。
荧光素酶报告基因实验
- 在本文中,研究者还采用了Luciferase assay用来研究转录因子在启动子区域的结合。我们会在MicroRNA套路课中详细地介绍Luciferase assay的相关原理和实验内容。在本篇转录因子的模板文章中,我们简单介绍一下运用Luciferase assay研究转录的实验原理。还可以阅读三十六策 Lesson 11和三十六策 Lesson 16以获得更多相关的知识。
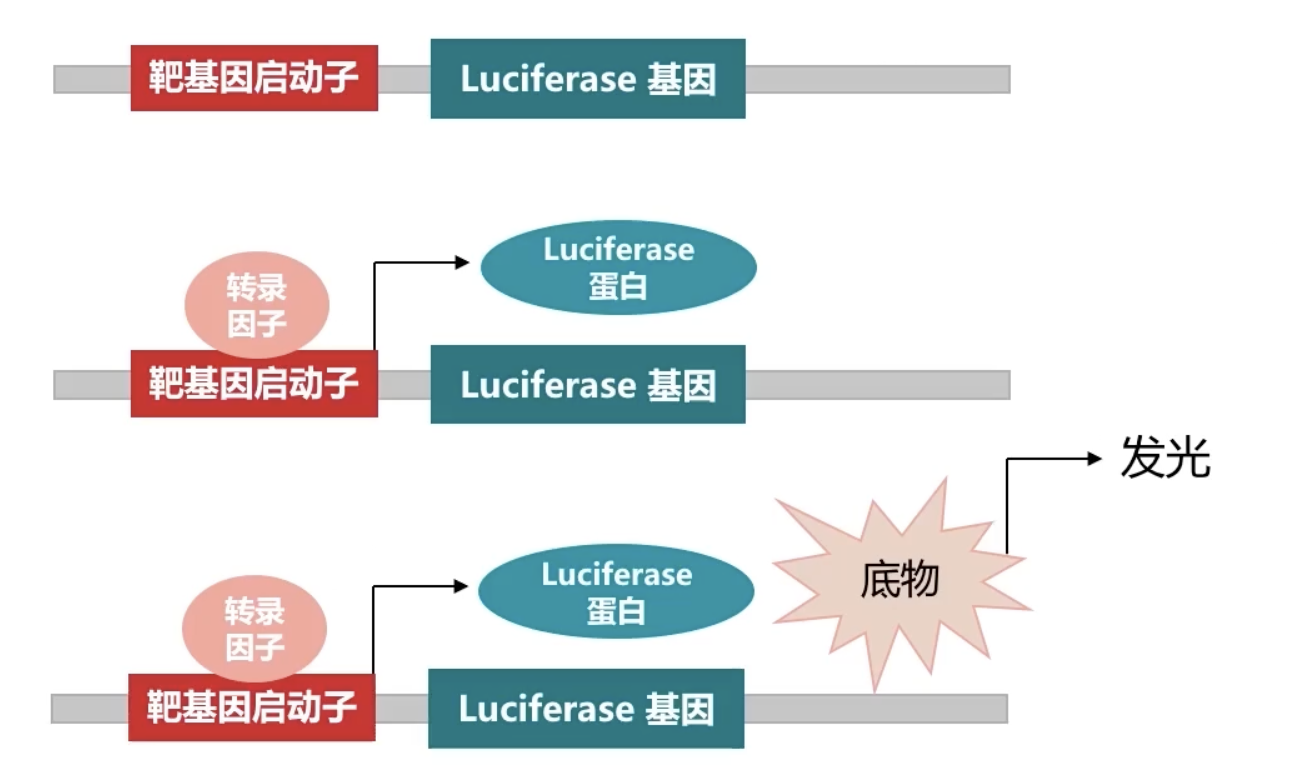
- 首先,我们需要构建一个特殊的荧光素酶质粒。在这个质粒当中,需要把转录因子可能结合的下游基因X的启动子克隆到荧光素酶基因的上游。然后把转录因子和这个荧光素酶质粒基因共同转染到细胞内。
- 如果可以在细胞实验中检测到荧光素酶的活性,说明转录因子可以和下游基因X的启动子相互结合。提示转录因子可以通过转录调节的方式调控下游基因X的活性。反之,转录因子对于下游基因X没有转录调控作用。
这个课题组持续多年聚焦于研究TTF-1基因和它的功能

- 他们最早在肺癌细胞中证实了TTF-1发生了基因拷贝数扩增现象。随后又对TTF-1下游的信号通路进行了详细的机制研究,发现TTF-1下游介导了三条信号通路。
- 第一条通路是TTF-1可以调控紧密连接Tight Junction。第二条通路是TTF-1可以调控分泌蛋白质组secretome。第三条通路是TTF-1可以调控microRNA的信号通路网络。特别是TTF-1作为转录因子,可以直接正向调控miR-33a的转录。
- 另外有其他研究团队的研究发现,miR-33a下游可以直接靶向ABCA1基因。因此在研究开始之前,研究者就推测出一条信号轴。在这条信号轴当中,TTF-1激活miR-33a,而活化的miR-33a抑制ABCA1的表达,从而达到抑制细胞内胆固醇外流的效果。这也是为什么论文一上来就研究细胞内胆固醇含量的原因。
TTF-1对于细胞内胆固醇含量的影响
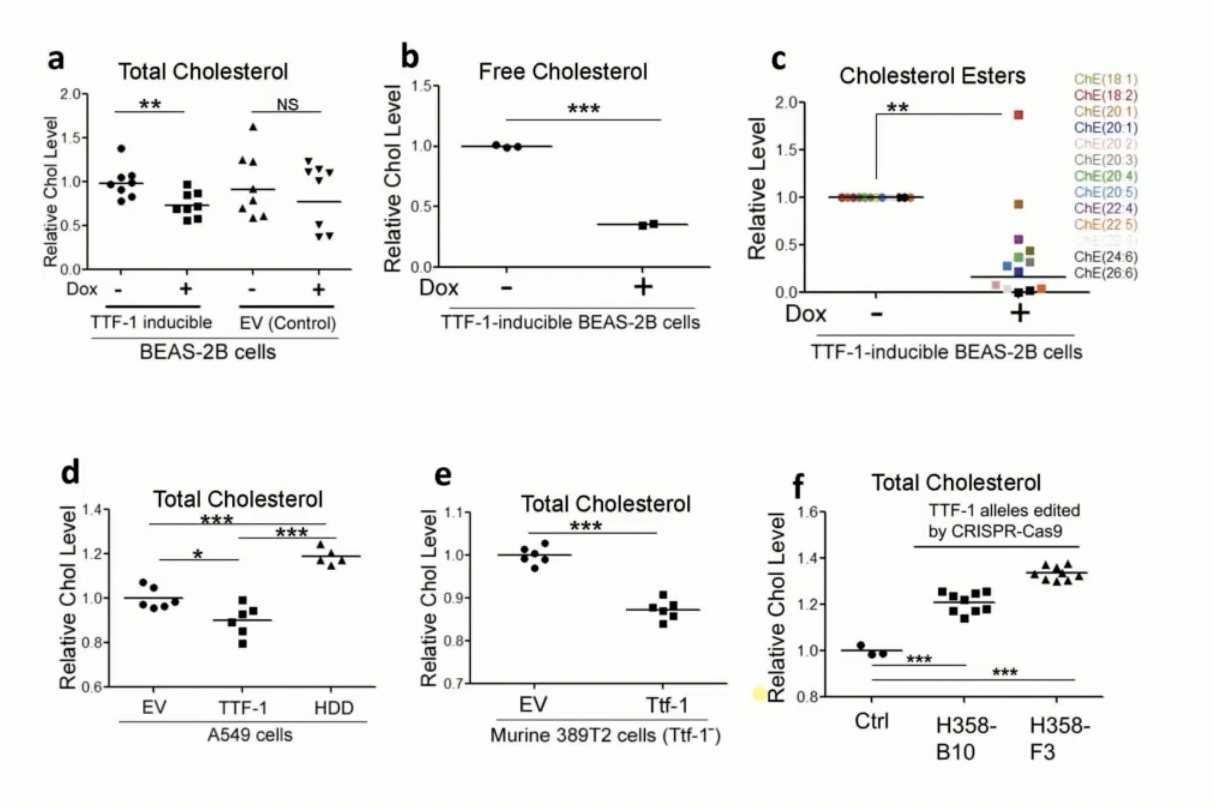
- 研究者采用了BEAS-2B细胞和四环素诱导系统Doxocycline Inducible System。在这个四环素诱导系统当中,如果细胞培养液内加入了四环素,可以诱导细胞过表达TTF-1。如果撤掉细胞培养剂内的四环素,就可以阻断细胞内的TTF-1的过表达。
- 研究结果显示,在加入四环素诱导细胞内TTF-1过表达之后,细胞内总的胆固醇含量是明显降低的。
- 由于总的胆固醇是由游离胆固醇和酯化胆固醇所组成,因此研究者又分别分析,当细胞TTF-1过表达之后,分别对游离胆固醇和酯化胆固醇的影响。结果又发现,只要TTF-1过表达,无论是游离胆固醇还是酯化胆固醇的含量都显著降低。在另一种TTF-1阴性的389T2细胞的细胞体系内,外源性过表达TTF-1同样可以导致细胞内的总胆固醇含量明显的降低。
- 既然TTF-1过表达之后导致细胞内胆固醇含量降低,那么敲除TTF-1的表达会有什么样的结果呢?研究者通过CRISPR-Cas9系统构建了TTF-1敲除的细胞系,分别是H358-B10以及H358-F3。在这两种TTF-1敲除的细胞内,总胆固醇含量显著升高。通过一正一反,也就是过表达+敲除实验研究,研究者证实TTF-1的表达量和细胞内的胆固醇含量呈现负相关性。
- 更进一步的研究证实,TTF-1介导的细胞内胆固醇含量的降低现象,依赖于TTF-1的DNA结合结构域,也就是homeo domain。因为在细胞内过表达homeo domain敲除的TTF-1,并不会导致胆固醇含量的降低。由于homeo domain是介导TTF-1转录活性的最重要的结构域,因此这个结果提示,TTF-1通过自身的转录能力最终调控了细胞内胆固醇的含量。而且TTF-1对于细胞内胆固醇的含量起到负向调控的作用。
TTF-1调控ABCA1的mRNA表达
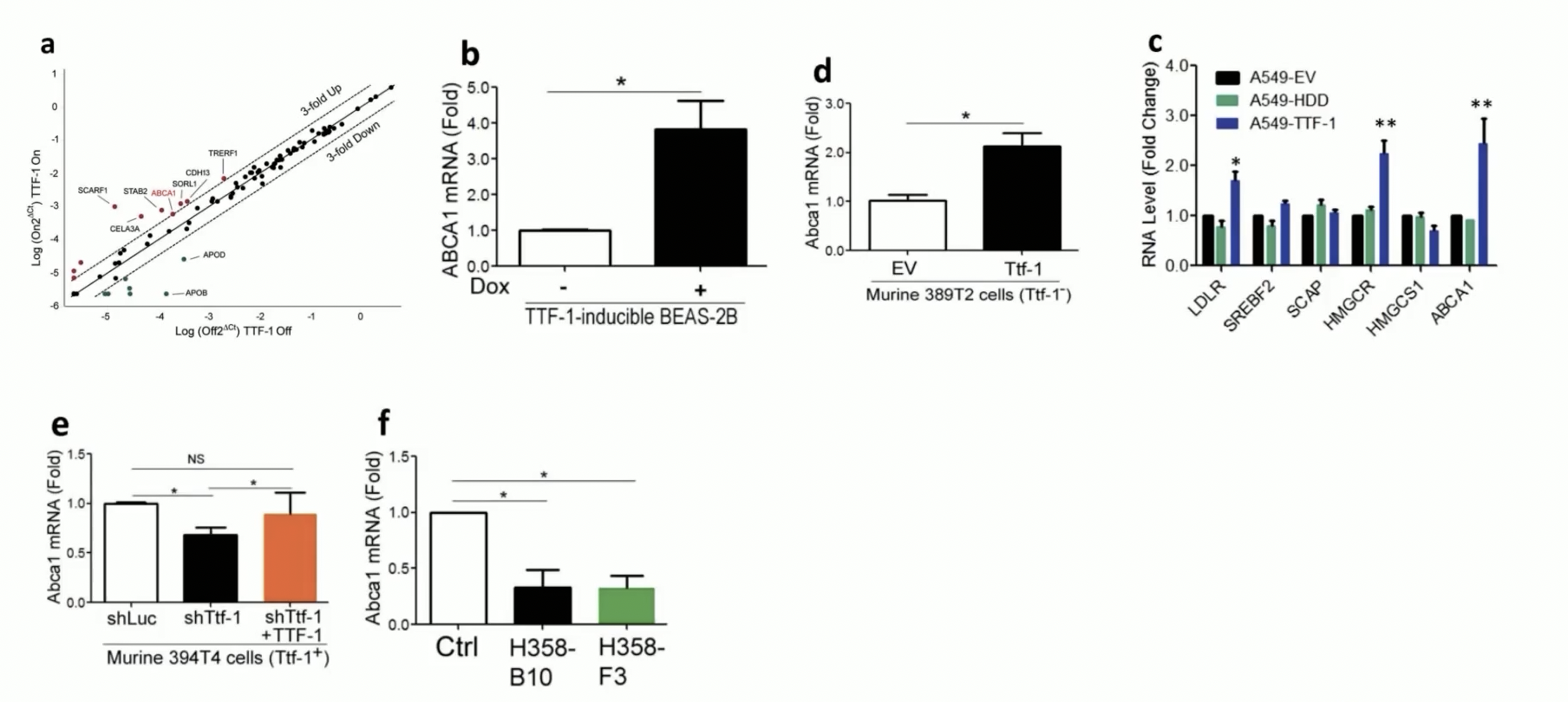
- 那么问题就来了,TTF-1下游转录调控了哪一个分子才最终影响了胆固醇含量呢?研究者采用了最经典的套路——高通量筛选,采用四环素诱导系统,将没有四环素孵育的细胞作为对照,将四环素孵育后诱导TTF-1过表达的细胞作为实验组。从而分析TTF-1高表达之后,表达发生显著改变的候选基因。研究者选取表达阈值是三倍,在受到TTF调控表达升高三倍的候选基因中,研究者选定了ABCA1。原因是因为TTF-1可以影响细胞内胆固醇含量,而ABCA1本身就是调控胆固醇流出,也就是cholesterol efflux的关键分子。因此研究者选择ABCA1进行后续的研究。
- 首先,通过细胞学实验和qPCR技术,证实细胞内过表达TTF-1之后,ABCA1 mRNA表达水平显著升高。无论是采用四环素诱导系统的细胞系,还是采用TTF-1阴性的389T2细胞,结果都是一致的。
- 其次,在细胞内分别过表达空载体、野生型TTF-1以及homeo domain敲除的TTF-1。结果发现:第一,ABCA1只有在野生型TTF-1过表达时,才会表达升高。由于homeo domain敲除的TTF-1没有下游基因的转录活性,因此可以推断TTF-1是通过转录的方式调控ABCA1的表达。第二,除了ABCA1的表达随TTF-1的升高而升高之外,另外还有两个分子,LDL-R,也就是低密度脂蛋白胆固醇受体,以及胆固醇合成的限速酶,羟甲基戊二酰辅酶A还原酶(HMGCR)的表达也随着TTF-1的表达升高而升高。
- 研究者研究这些分子的原因是因为胆固醇是细胞膜的主要组分,因此细胞内存在一种胆固醇的稳态机制,也就是始终让细胞内的胆固醇的含量保持在一定范围之内。当TTF-1过表达导致ABCA1过表达,产生过量胆固醇外流现象之后,细胞内的胆固醇水平过低,在细胞内会启动相关的负调控机制,比如研究中观察到LDL-R和HMGCR的表达也随之升高。目的就是为了保证胆固醇的稳态,其中LDL-R,也就是低密度脂蛋白胆固醇受体,表达升高后,细胞可以从细胞外部摄取更多的胆固醇,这种作用就被称之为Uptake吸收。而HMGCR是胆固醇合成过程中的限速酶,细胞通过上调HMGCR,使得胆固醇在细胞内的生物合成速率提高。
- 总而言之,为了保证细胞内胆固醇的稳态,虽然TTF-1升高之后,诱导ABCA1升高,导致胆固醇外流加剧,但是细胞内从外部摄取胆固醇的受体,LDL-R和胆固醇的生物合成速率都显著加速,从而保证细胞内胆固醇的稳态。另一点需要大家特别注意的是,LDL-R和HMGCR,尤其是HMGCR,是他汀类药物的作用靶点。这也就是为什么在后续的研究当中,研究者会研究TTF-1对于他汀类药物敏感性的问题。
- 除了在细胞内过表达TTF-1之外,研究者还采用了rescue和基因敲除的手段,证实TTF-1对于ABCA1的调控作用。首先,在394T4细胞内,通过RNAi的干扰手段,敲减了细胞内源性TTF-1,结果导致ABCA1的mRNA水平显著降低。随后,在敲减细胞内,通过过表达外源性TTF-1,可以使ABCA1的mRNA水平显著上调,rescue成功。在TTF-1基因消除的细胞B10和F3细胞内,ABCA1mRNA的水平也是显著降低的。因此,在Fig.2中,作者首先通过高通量筛选获得候选基因ABCA1,随后通过过表达和rescue以及基因敲除实验,证实TTF-1对于ABCA1具有正向调控作用。
怎么确定TTF-1调控ABCA1的机制
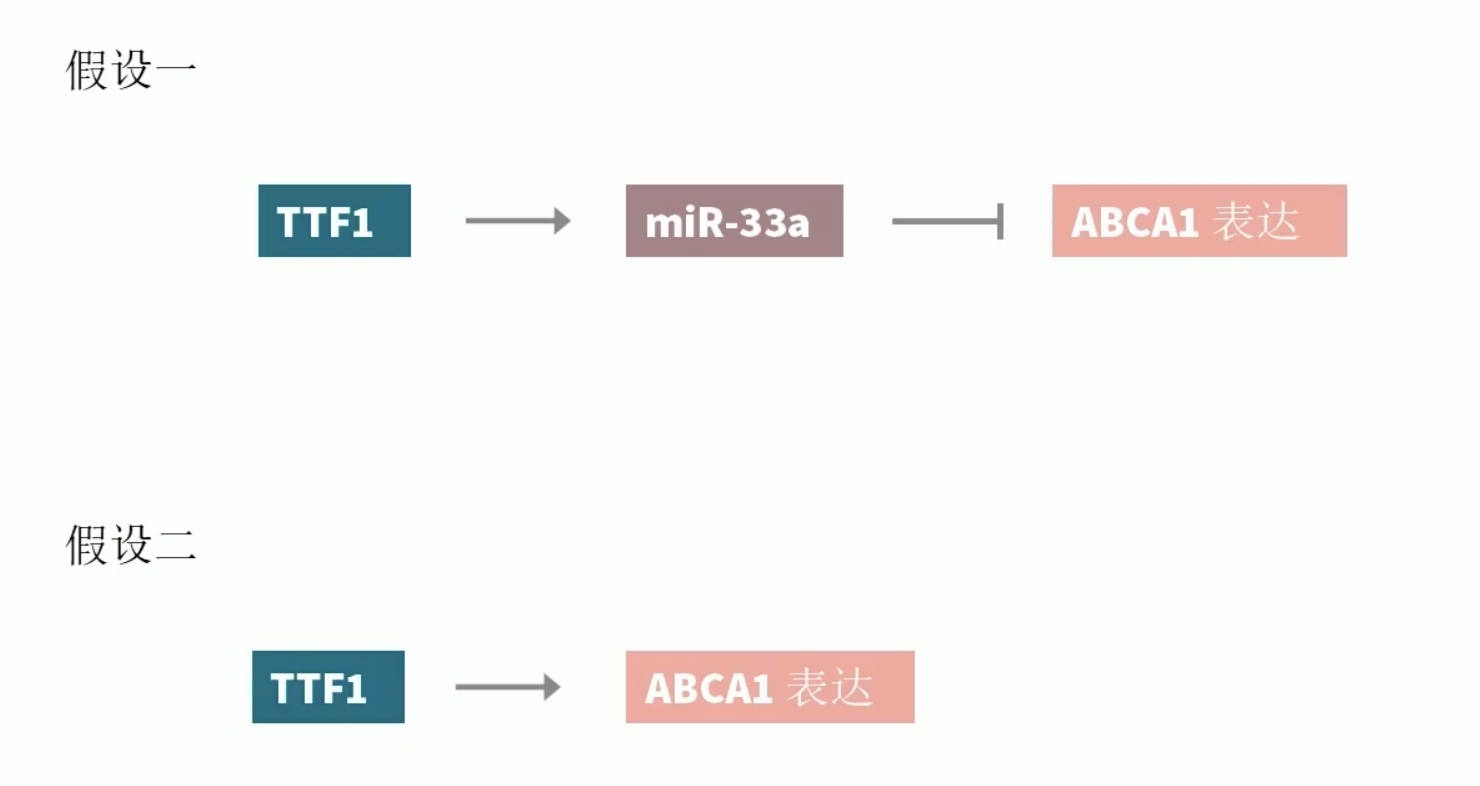
- 至此,通过Fig.一和Fig.二的研究,作者证实TTF-1负调控细胞内的胆固醇含量,但是与此同时,TTF-1又可以正向调控ABCA1的mRNA的表达,但是TTF-1调控ABCA1的mRNA的机制仍然是未知的。
- 在证实了TTF-1可以正向调控ABCA1之后,自然会引出一个问题,TTF-1调控ABCA1的机制是什么?因为homeo domain缺失的TTF-1没有能力调控ABCA1,因此,TTF-1是通过转录调控的方式,调节ABCA1的表达。这种TTF-1诱导的转录调控方式会有两种,第一种是TTF-1通过mRNA的调控,间接的调控ABCA1,第二种调控机制是TTF-1直接转录调控ABCA1。
- 研究者之所以提出第一种调控方式,是因为在研究者自己的前期工作当中已经证实了TTF-1可以转录调控的方式正向调控miR-33A的表达。而其他研究团队又证实了miR-33A可以靶向ABCA1,从而调控细胞内胆固醇的含量,因此,一种可能的机制就是,TTF-1促进miR-33A的转录,而miR-33A表达升高后抑制ABCA1,从而减少胆固醇外流,使得细胞内的胆固醇含量升高。
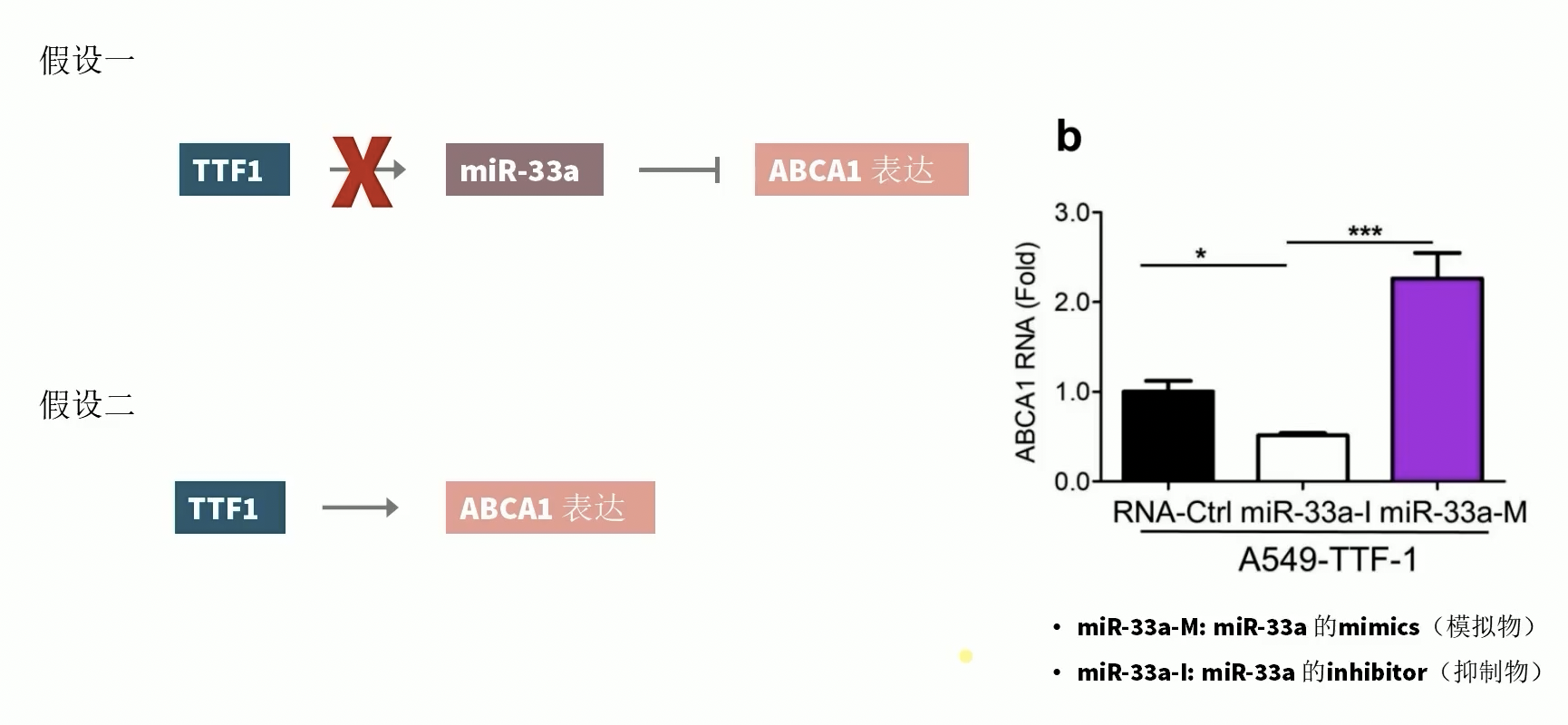
- 假设一和实验结果并不相符,因为本文中的Fig.1实验结果已经证实,TTF-1升高之后导致细胞内的胆固醇含量降低,而并非是假设一中所推断的胆固醇含量升高。而且,进一步的细胞学实验证实,在细胞内过表达miR-33A的mimics模拟miR-33A的表达升高,并没有抑制ABCA1的mRNA的含量,相反,在细胞内过表达miR-33A的抑制剂也没有提升ABCA1的表达量。因此,TTF-1通过miR-33A调控ABCA1的通路,至少在研究者的实验体系内是不存在的,所以TTF-1可能直接调控了ABCA1的转录。
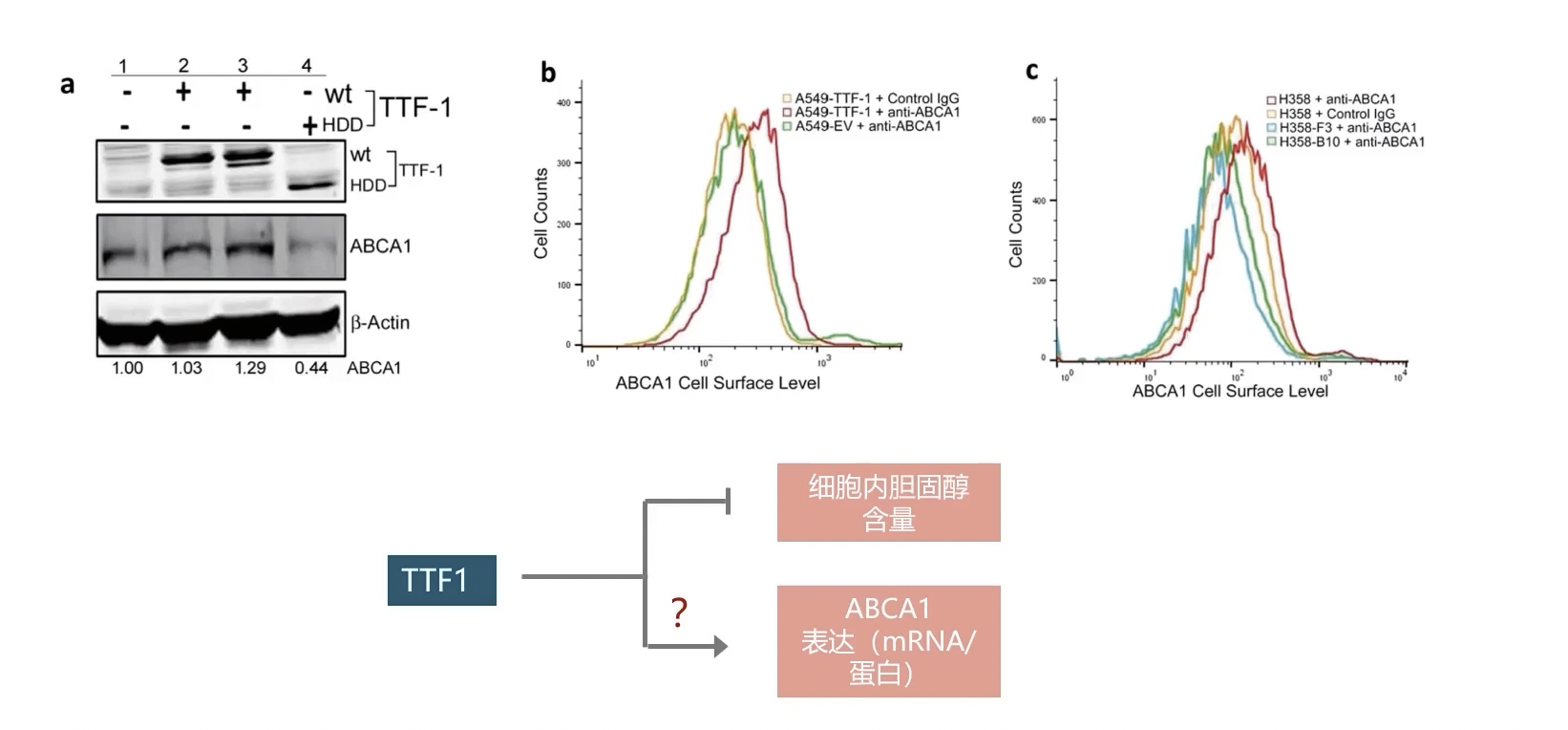
- 在验证TTF-1对于ABCA1的直接转录调控作用之前,为了进一步验证TTF-1对于ABCA1蛋白的表达调控水平,研究者把野生型TTF-1和homeo domain敲除的TTF-1转染入A549细胞内,通过Western blot检测了ABCA1的蛋白表达水平的变化。结果显示,只有野生型的TTF-1能显著促进ABCA1蛋白的表达,而homeo domain敲除的TTF-1没有这个功能。
- 因为ABCA1是一种膜蛋白,而且只有整合入细胞膜之后ABCA1才能发挥作用,使细胞内的胆固醇外流。因此,研究者进一步研究由TTF-1诱导的ABCA1的蛋白表达升高现象是不是发生在细胞膜上。研究者选用可以结合细胞膜上ABCA1的蛋白的抗体,用以标记膜结合ABCA1。流式细胞检测发现,当TTF-1在A549细胞内过表达之后,细胞膜上ABCA1的表达量是明显升高的,因为曲线往右移动。相反,在TTF-1消除的B10和F3细胞内,细胞膜上的ABCA1蛋白表达水平显著降低,因为曲线往左移动。所以,TTF-1的表达不仅促进了ABCA1 mRNA水平的表达,而且还促进了ABCA1蛋白水平的表达。
TTF-1直接转录激活ABCA1
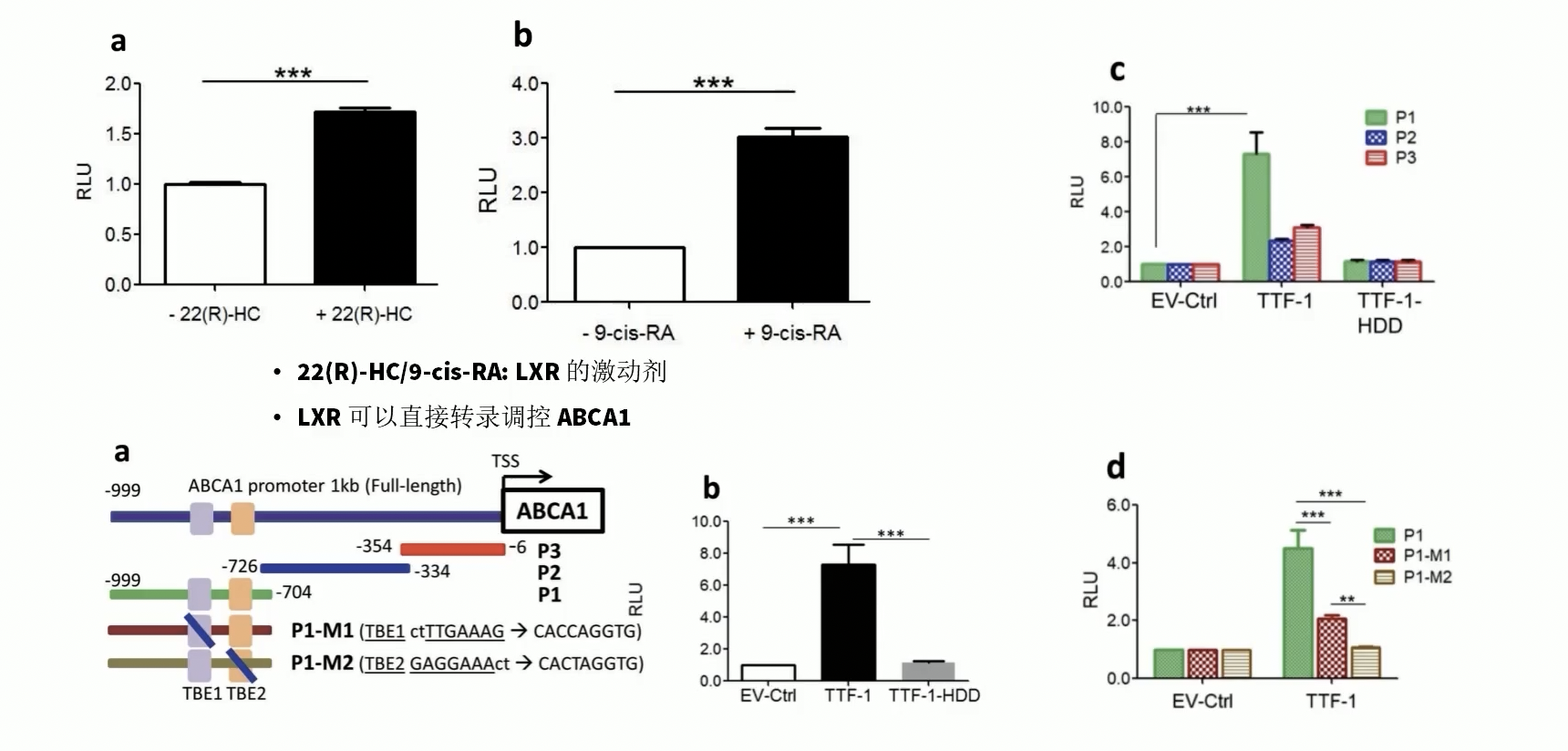
- TTF-1调控ABCA1的第二种模式是直接的转录调控作用,因为TTF-1本身就是转录因子,因此TTF-1有可能通过直接结合到ABCA1启动子区域,从而直接调控ABCA1的表达水平。
- 研究者首先把ABCA1基因上游1KB的序列直接克隆到荧光素酶报告基因上游,然后通过LXR的激动剂进行了启动子功能验证。正如我们在背景介绍中提到的,LXR是可以结合到ABCA1启动子区域的转录因子。因此LXR的激动剂能直接激活LXR,使得LXR通过结合到启动子区域,激活报告基因中荧光素酶,最后通过加入底物检测到信号。通过LXR的激动剂实验,证实ABCA1基因上游1KB片段之内确实包含了ABCA1基因的启动子。
- 随后,这个含有1KB ABCA1启动子序列的Luciferase assay载体,以及野生型的TTF-1或者是homeo domain缺失的TTF-1共转入细胞。结果只有野生型TTF-1可以检测到信号,说明TTF-1可以结合到ABCA1上游1KB的启动子区域内。
- 但是到底哪一段序列才是真正受到TTF-1调控的基因序列呢?研究者首先进行了transcation实验,把1KB区域从5’-端到3’-端分为P1,P2和P3三个部分。三个部分之间含有重叠的区域,再把含有这三个片段的载体和野生型TTF-1或是homeo domain缺失的TTF-1共转入细胞。结果只有含有P1序列的载体才能检测到信号。说明TTF1结合的序列位于ABCA1基因上游999位到704位之间。
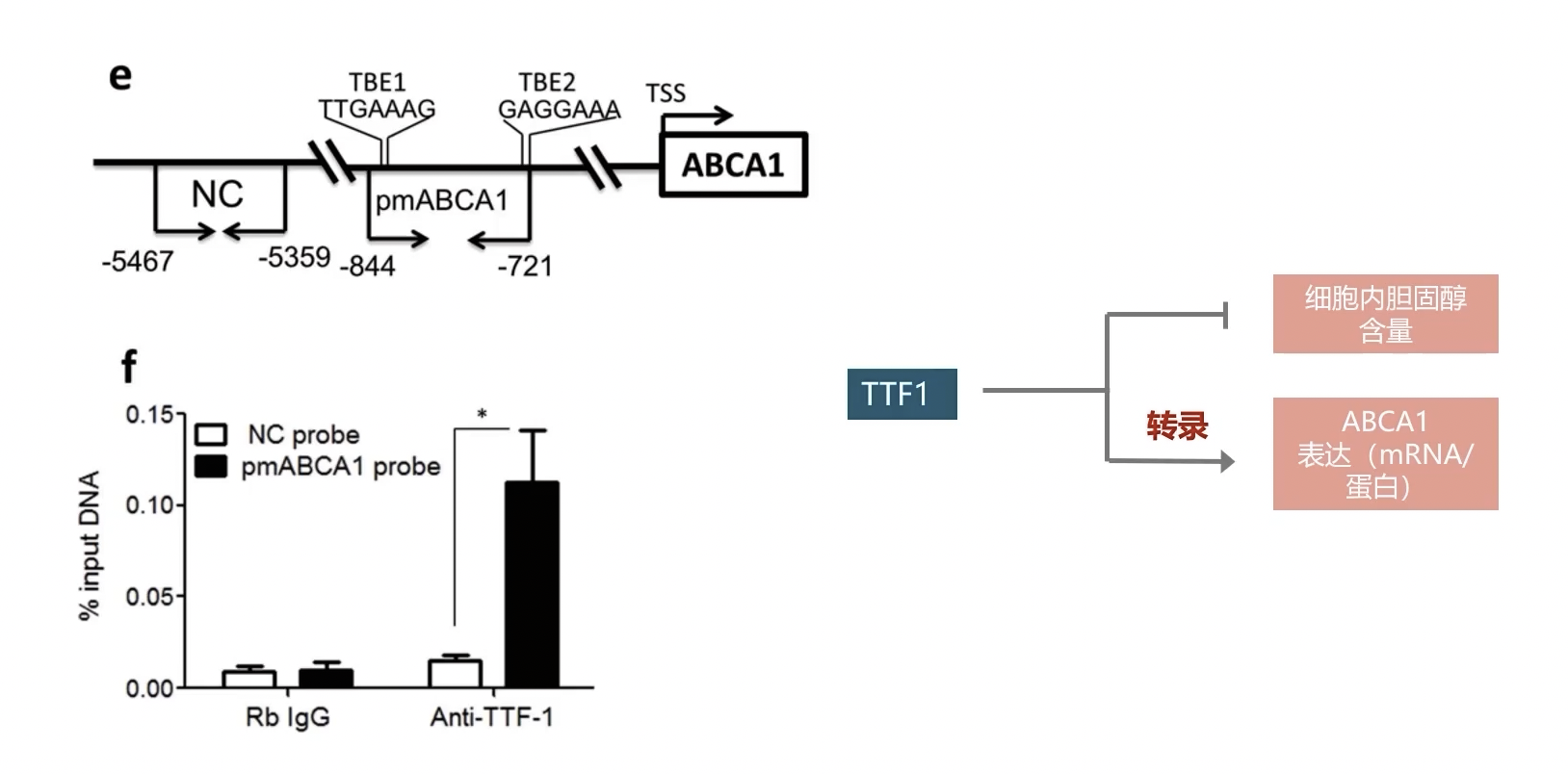
- 进一步的分析发现,P1序列内含有两个TTF-1结合元件(TTF-1 Binding Element,TBE)分别是TBE1和TBE2。如果突变TBE序列,可以显著的抑制TTF-1和P1区域的结合。最后,为了进一步验证TTF-1和P1区域是否可以发生相互作用,研究者采用染色质免疫共沉淀结合qPCR,也就是ChIP-PCR技术进行进一步的验证。通过TTF-1抗体结合TTF-1蛋白并且进行富集,由于TTF-1作为转入因子可以结合相应的DNA片段,因此在富集过程中和TTF-1相互结合的DNA片段也同样可以获得富集。最后,通过qPCR检测相关的DNA片段。ChIP-qPCR以及ChIP-Seq相关技术,我们会在第四讲中详细介绍。
- 在ChIP-qPCR实验中,研究者设计了两组引物。一组引物识别ABCA1基因上游5KB处的DNA序列,这组引物是作为对照的,而另一组引物识别ABCA1基因上游844位到721位的序列,正好位于P1区域的内部,包含了TBE序列。ChIP-qPCR结果显示,P1序列可以获得显著的富集,提示TTF-1可以和P1序列发生相互结合。
- 综上所述,TTF-1可以直接和ABCA1的启动子区域结合,并且激活ABCA1的转录。
TTF-1调控胆固醇外流
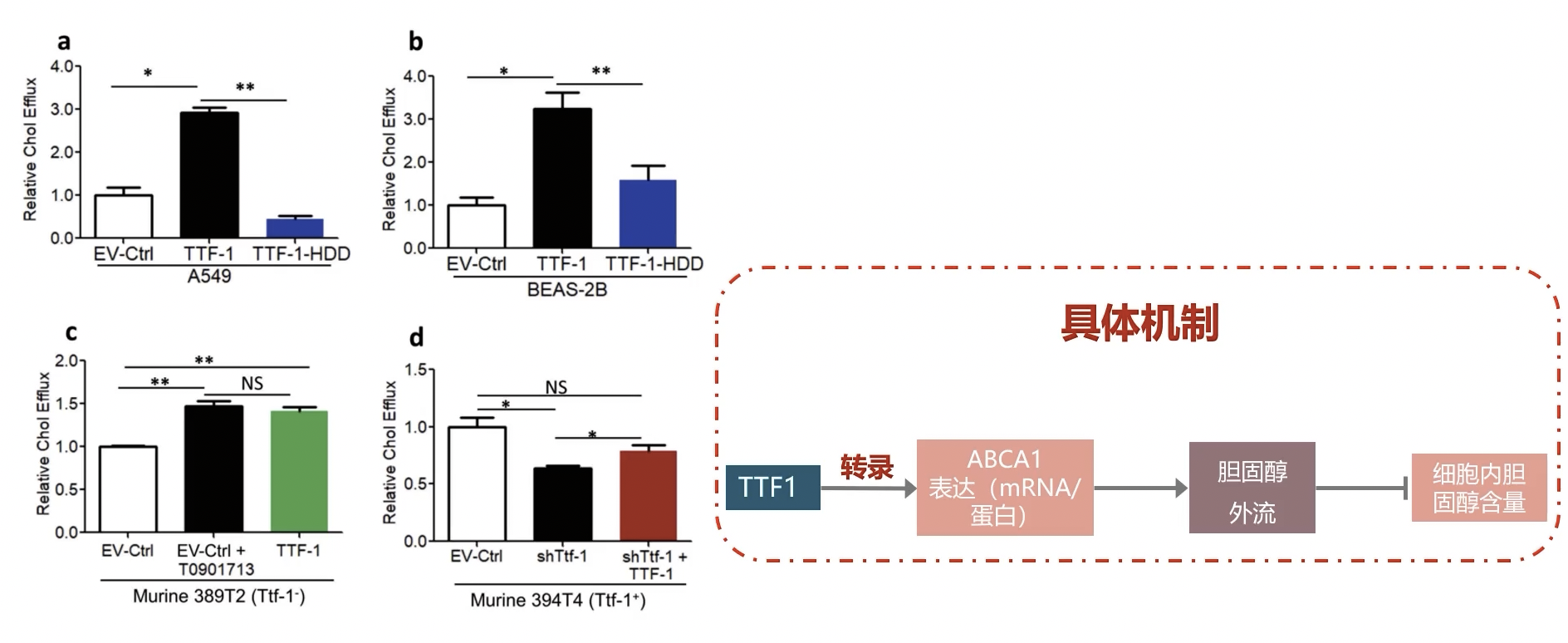
- ABCA1是介导细胞内胆固醇外流,也就是Cholesterol efflux的关键分子。因此如果TTF-1可以直接调控ABCA1的表达,那么TTF-1也就可以通过ABCA1进而影响细胞内胆固醇的外流,所以TTF-1和胆固醇外流之间应该存在正相关性。为了验证这一点,研究者在A549和BEAS2B细胞内检测了胆固醇外流现象。研究者采用Cholesterol efflux assay进行了验证。
- 这个实验的原理是,首先把特殊标记的胆固醇加入培养基,并且让培养基和细胞进行孵育。这样特殊标记的胆固醇就会被细胞摄入细胞内。随后舍弃培养基并加入全新而且不含有特殊标记胆固醇的培养液,再和细胞孵育过夜。这时如果细胞内胆固醇发生外流现象,培养基当中就会积累被特殊标记的胆固醇。最后收集培养基上清,检测上清中所含有的特殊标记的胆固醇含量。所含特殊标记胆固醇越多,说明细胞内胆固醇外流现象越严重,反之亦然。
- 在A549细胞和BEAS2B细胞内,过表达TTF-1可以使外流的胆固醇升高大约3~4倍,相反,homeo domain缺失的TTF-1并没有这样的功能。随后,研究者又在TTF-1阴性的389T2细胞内,检测TTF-1对于细胞内胆固醇外流现象的影响。结果显示,TTF-1过表达之后,同样促进了细胞内胆固醇的外流。而且,如果用LXR的激动剂T0901713激活LXR,也可以促进细胞内胆固醇的外流现象。LXR的激动剂实验,在这里相当于是一个阳性对照实验,因为LXR激活之后,可以通过转录调控ABCA1的表达升高,这是已知的现象。
- 最后,研究者通过rescue实验,验证了TTF-1对于胆固醇外流的影响在细胞内通过RNAi干扰,抑制TTF-1的表达,可以显著抑制胆固醇外流。如果在TTF-1敲减的背景之下,再过表达TTF-1,可以rescue这种现象。总之,TTF-1可以通过胆固醇外流(Clestroiflux)的方式,导致细胞内胆固醇含量降低。至此,全文的主要的机制研究已经完成。研究者发现在细胞内TTF-1表达升高之后,可以通过直接的转录调控方式,升高细胞内ABCA1的mRNA和蛋白表达量。细胞内ABCA1蛋白表达升高之后,整合到细胞膜上的ABCA1也相应升高,并介导了胆固醇外流,最终导致细胞内胆固醇含量降低。
TTF-1促进了细胞对他汀类细胞的敏感性
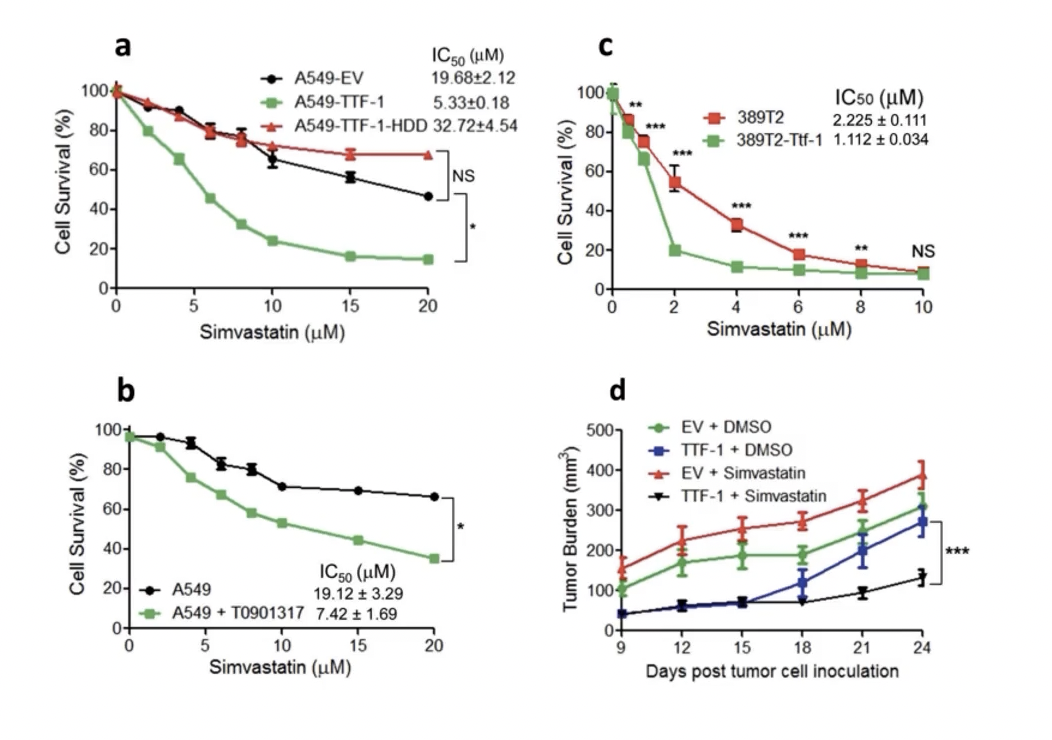
- 最后,研究者研究TTF-1高表达是否会影响细胞对于他汀类药物的敏感性。之所以研究者会进行这方面的研究,是因为TTF-1过表达之后,会影响细胞胆固醇的含量,而胆固醇本身又是细胞膜的主要组成成分。在Fig.2C中,研究者发现TTF-1过表达之后,除了诱导ABCA1过表达之外,也会导致LDL-R和HMGCR这两个分子的高表达,而HMGCR本身就是他汀类药物的主要作用靶点。
- 因此,研究者推测,由于TTF-1高表达,可能会导致细胞对于他汀类药物更加敏感。在Fig.6A中,TTF-1过表达之后,使得A549细胞对于辛伐他汀更为敏感,因为曲线下移。而作为对照,homeo domain缺失的TTF-1并没有影响A549对于药物的敏感性。在Fig.6B中,LXR的激动剂T0901317同样能使A549对于辛伐他汀变得更为敏感。这个结果和过表达TTF-1是类似的。在TTF-1阴性的389T2细胞内,如果过表达TTF-1,同样会使389T2细胞对于辛伐他汀更为敏感,同样会使曲线下移。
- 最后,研究人员采用了动物模型来验证TTF-1和辛伐他汀对于肿瘤的影响。首先进行皮下接种实验,然后在皮下接种的第9天,开始测量接受DMSO处理的移植瘤大小和接受辛伐他汀处理的移植瘤的大小。结果显示,移植瘤体积最小的实验组使细胞内过表达TTF-1并且接受了辛伐他汀处理的实验条件。动物实验结果证实,TTF-1过表达的肿瘤细胞对于辛伐他汀的敏感性显著增强。
- 整篇文章的最后,研究者通过网络数据库的查询,进行了相关临床数据的验证。研究者通过UCSC网站数据,在5个肺癌基因组数据库和一个甲状腺癌基因组数据库当中,分析了TTF-1和ABCA1 RNA表达相关性。其中在3个数据库中,TTF-1和ABCA1的RNA表达相关性具有统计学差异。在TCGA数据库当中,在肺腺癌和肺鳞状细胞癌数据库中,研究人员检测了TTF-1 DNA拷贝数和ABCA1 RNA表达水平的相关性,结果显示TTF-1的拷贝数和ABCA1 RNA表达水平在肺腺癌中具有显著性的差异。
总结
- 最后,我们总结一下这篇论文所发现的信号通路和机制。细胞内TTF-1表达升高,通过转路调控的方式诱导ABCA1表达增强。随后由于ABCA1介导的胆固醇外流现象导致细胞内的胆固醇含量降低,最终使得细胞对于他汀类药物的敏感性升高。















