使用的文献:Thyroid transcription factor 1 enhances cellular statin sensitivity via perturbing cholesterol metabolism

- 之前我们讲到的多种机制,例如通过蛋白的翻译后修饰机制调控转录因子的转录活性、转录因子的平台效应、包括转录因子结合方向的重新定位机制等等,都是转录因子对于下游基因的转录调控机制。但是,生物体内的关键生物学过程不会只有一个层次的调控,而是会有多个层次的调控作用机制,从而形成一个网状调控的模式。而转录因子本身也是由基因所编码,也同样可以受到多重机制的调控。
- 在本节内容当中我们就来介绍转录因子所受到的调控作用,这些机制包括转录因子的合成、转录因子和相关调控因子的亚细胞定位调控,以及转录因子和不同的转录调控因子相结合从而受到调控的机制。
- 转录因子本身也是一种蛋白质,同样是由染色体上的基因编码,并且通过转录形成RNA,然后RNA通过翻译过程再形成蛋白发挥作用。因此,从中心法则的角度看,转录因子作为一个蛋白,同样可以受到转录调控、转录后调控、翻译过程中的调控,以及翻译后调控等多个层次。
转录因子的自我调控模式
- 由于篇幅有限,我们不可能从那么多的层次为大家一一讲解,我们挑选了一种转录因子所特有的调控方式为大家进行介绍。这种特殊的调控方式被称为自我调控模式。所谓的自我调控模式指的是转录因子可以调控转录因子本身。例如,在一种负反馈环路中,转录因子可以作为它自身转录的抑制因子,当某个转录因子A结合到编码A基因的转录调控区域之后,转录因子A会抑制基因A的转录,从而始终在细胞内保持转录因子A的低表达。
举例:胚胎干细胞(ES细胞)中的Nanog和Oct4
- 胚胎干细胞具有自我更新的能力,在胚胎干细胞进行自我更新时,ES细胞始终保持了细胞的干性,就是指胚胎干细胞能够在合适的条件下,分化为几乎所有类型的细胞的能力。
- ES细胞保持干性很关键的一个原因,是ES细胞内表达了一系列的转录因子,比如Oct4和Nanog。通过这些转录因子之间的相互调控,维持了ES细胞的干性。
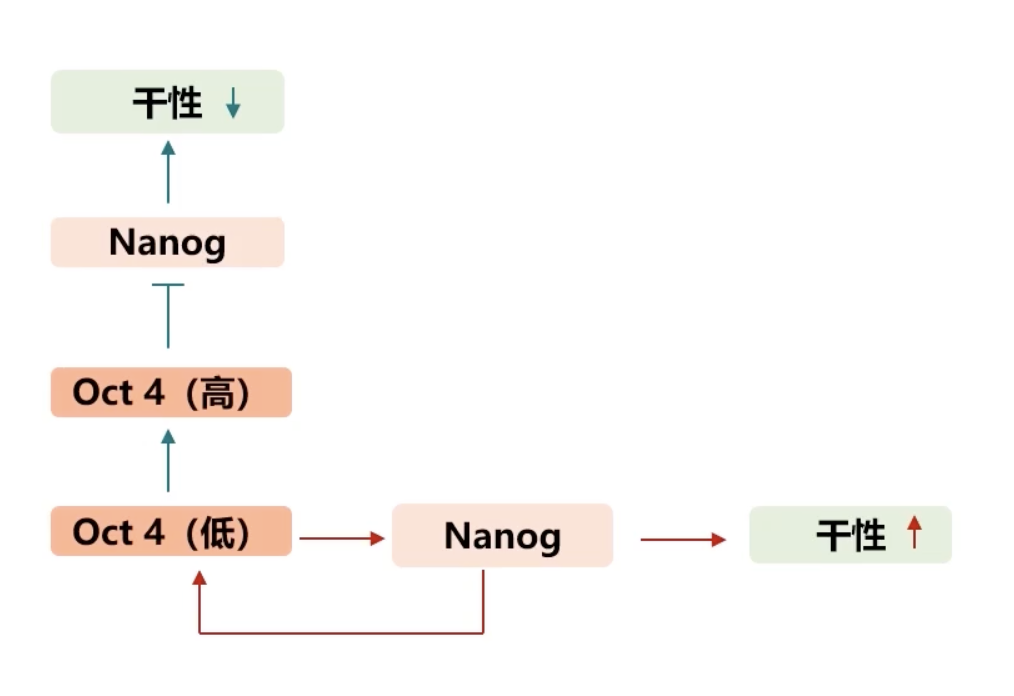
- 目前,研究显示转录因子Nanog的高表达可以维持ES细胞的多能性,而Oct4对于细胞干性的维持则起到了双向调控的作用。
- 当Oct4表达量比较低的时候,Oct4能直接结合到Nanog的启动区域,从而维持Nanog的表达量,并激活Nanog的活性,维持ES细胞的干性。
- 当Oct4表达量很高的时候,Oct4起到相反的作用。高表达的Oct4抑制了Nanog的活性,从而抑制了ES细胞的干性。
- 另有研究发现,Nanog表达活性升高之后,也可以激活Oct4的表达,这样就形成了一个看似有矛盾的现象:在ES细胞内,Oct4处于低表达的状态,从而促进了Nanog的表达。由于Nanog始终处于高表达且高活性的状态,从而维持了ES细胞的干性,但是Nanog高表达之后可以激活Oct4的表达。当Oct4表达量升高后,又抑制了Nanog的活性,从而抑制ES细胞的干性。换而言之,保持ES细胞干性的Nanog分子本身也是细胞干性的终结者,也就是下面这张图的内容。
- 但是,在实验中观察到的现象却是ES细胞内Nanog始终处于高表达状态,而Oct4始终处于低表达的状态。也就是高表达的Nanog所诱导的Oct4的表达升高现象在ES细胞内没能观察到,对这一机制的解释可以见下图:
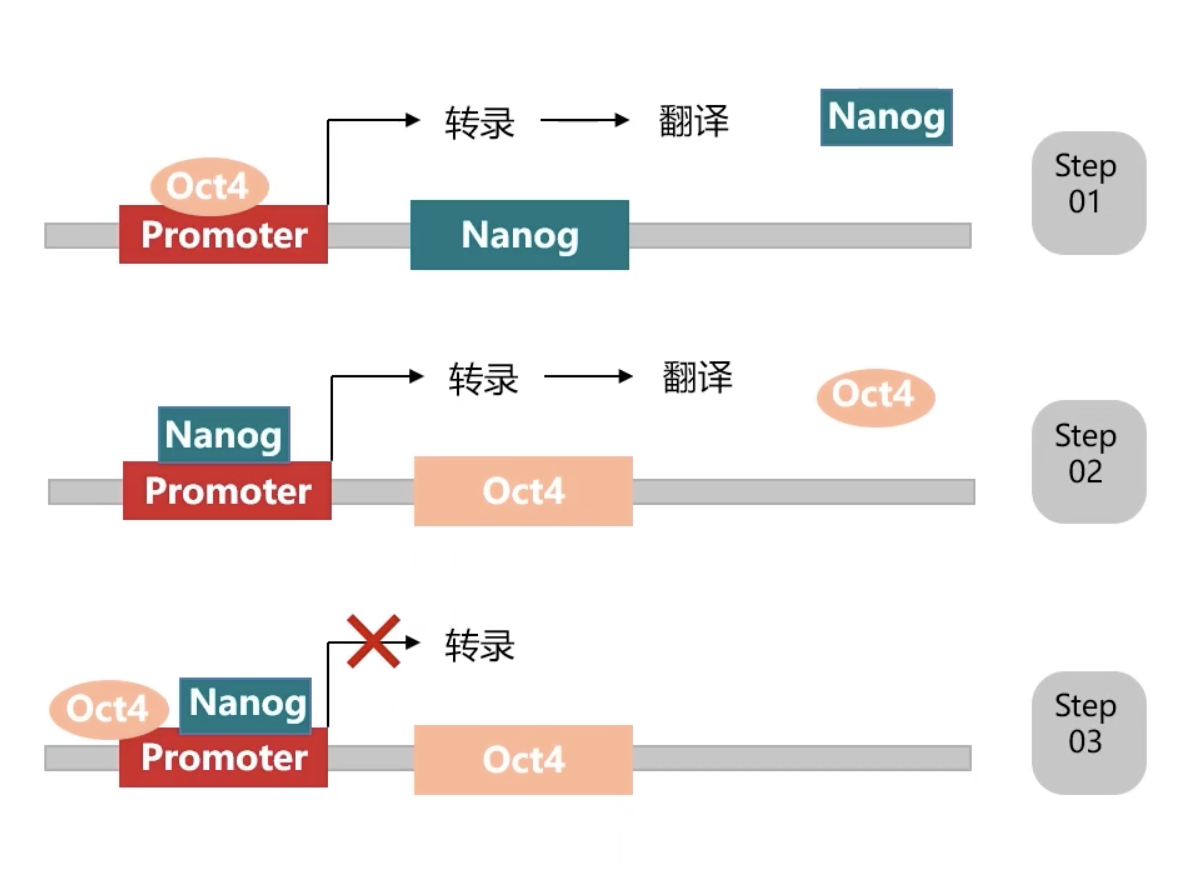
- 详细的机制研究证实,当Nanog活性增高,促进了Oct4表达升高。表达升高后的Oct4会结合到Oct4基因自身的转录调控区域,反而抑制了Oct4的表达。因此,转录因子Oct4蛋白介导的Oct4基因的转录抑制现象,抵消了Nanog诱导的Oct4基因表达升高的现象,从而使得Oct4的蛋白始终在ES细胞内保持较低的表达水平。这种转录因子A抑制编码转录因子A自身基因表达的现象,就是一种带有负反馈机制的自我调控模式。
对转录因子亚细胞定位的调控
- 编码蛋白的mRNA是在细胞核内被转录出来的,而且被转运到细胞质中,再被翻译成蛋白发挥作用。转录因子也是一类蛋白,编码转录因子的mRNA也是在细胞核内转录,然后在胞浆内翻译成转录因子蛋白。但是转录因子只有在进入细胞核内,并且和DNA序列结合之后,才能发挥作用,调控下游基因的转录。细胞可以利用转录因子的这种特性,通过调控转录因子蛋白在细胞内的亚细胞定位,从而调控转录因子的功能。
- 有两种常见的模式:
调控转录因子的胞浆驻留
- 转录因子的胞浆驻留:细胞通过某种途径,让转录因子蛋白驻留在胞浆内,根本无法进入细胞核,也就无法发挥基因调控的作用了。
- 我们以NF-κB为例进行说明:我们通常说的NF-κB不是一个分子,而是一个家族,包含五个成员分别是p65、RELB、CREL、p50以及p52。每一个成员都含有一个保守的N-末端同源结构域,能发挥核定位、DNA连接和介导同源二聚体或异源二聚体的作用。我们通常所说的NF-κB指的是形成二聚体化的蛋白复合物通常是指p50-p65二聚体。
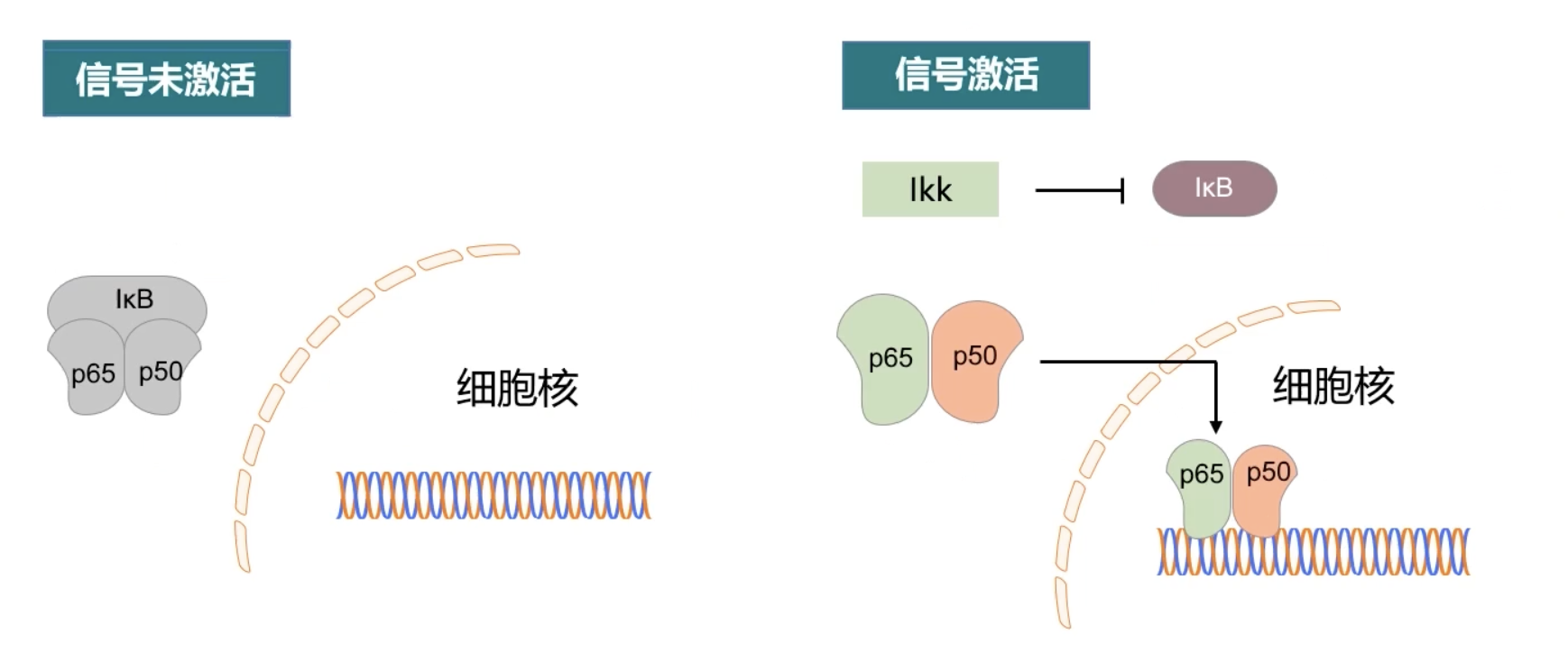
- 当NF-κB通路没有激活的时候,NF-κB在胞浆内和NF-κB抑制因子i-κB相互结合。i-κB全称是Inhibitor of NF-κB,通过分子的名称我们就能知道NF-κB和i-κB在胞浆内所形成的复合物是抑制NF-κB功能的,其原因是NF-κB被驻留在了胞浆内,不能入核,调控下游基因的转录。
- 当NF-κB信号激活之后,i-κB激酶IKK被激活,IKK磷酸化i-κB,并且导致i-κB最终经过泛素化途径,被细胞内的蛋白酶体所降解,使得NF-κB重获自由,进入细胞核激活了含有NF-κB的DNA结合位点的基因表达。这些基因的激活产生一系列的生理或病理效应,例如炎症或免疫反应等现象。同时,NF-κB的入核也激活了自身抑制蛋白i-κB的表达,新合成的i-κB再反过来和NF-κB相互结合,并抑制NF-κB的功能,如此形成反馈环路,调节NF-κB的活性。
转录调控因子的亚细胞定位
- 在我们上面介绍的NF-κB的例子当中,转录因子NF-κB的转录活性是通过调节NF-κB的亚细胞定位来进行调控的。转录因子还有一种特殊的调控方式:因为有些转录因子本身虽然也可以和DNA序列相互结合,但是它们之间的结合并不紧密,转录的调控作用也不显著。在某些刺激条件之下,转录因子为了刺激转录,而招募更多的转录调控蛋白,从而形成更为复杂的转录复合物,增强了转录因子和DNA序列的结合,也同样增强了下游基因的转录。
- 我们以转录复合物ISGF3为例进行说明。Ⅰ型干扰素在刺激细胞之后会激活下游很多基因的活化,在这个过程当中,需要转录复合物ISGF3的参与。ISGF3全称是Interferon Stimulated Gene Factor 3干扰素刺激基因因子3,它是一个转录复合物,含有多个因子。其中最重要的是ISGF3γ和ISGF3α。
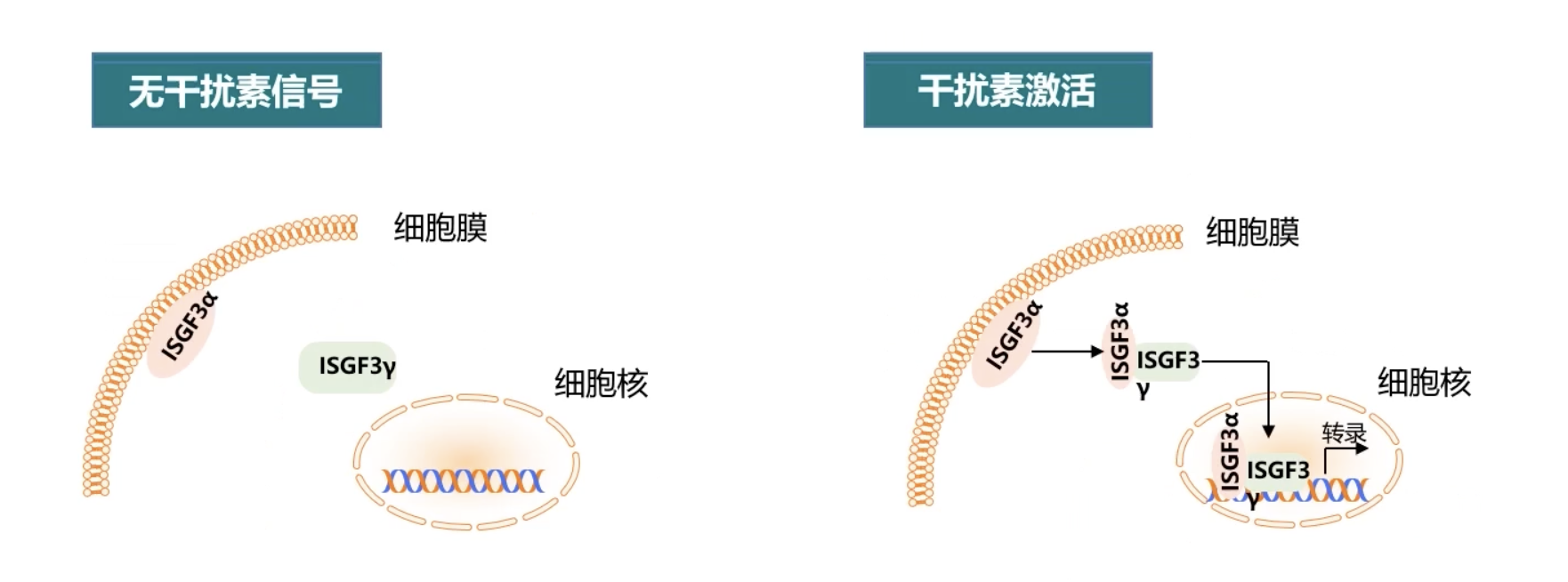
- 在没有干扰素刺激的时候,ISGF3γ主要定位在胞浆内,虽然也有发现ISGF3γ可以入核,但是它和DNA之间的结合是非常微弱的,起不到下游基因的转录调控作用;而ISGF3α以一种膜结合的方式,定位在细胞膜上。
- 当干扰素刺激之后,ISGF3α被激活,并且从细胞膜上释放,获得自由的ISGF3α和胞浆内的ISGF3γ相互结合,形成成熟的ISGF3复合物。成熟的复合物从胞浆内转位到细胞核内,和干扰素刺激调控元件ISRE序列结合,之后调控了下游基因的转录表达。
- 在整个调控过程中,ISGF3α没有DNA的结合能力,它本身并不是一个转录因子只是一个转录调控因子,而具有转录活性的ISGF3γ虽然有DNA结合能力,但是单独的ISGF3γ和DNA的结合力非常弱,也起不到下游基因的调控作用。只有当二者相互结合,形成成熟的ISGF3复合物之后,才能介导干扰素诱导的下游基因的转录调控作用。因此转录调控因子ISGF3α的亚细胞定位对于整个复合物,包括ISGF3γ的转录活性具有重要的调控作用。
转录因子结合不同的转录调控因子
- 转录因子和不同的转录调控因子结合,介导转录因子下游的不同功能。
- 我们以雌激素受体为例:雌激素受体(Estrogen receptor,ER)是核受体超家族的成员之一,参与了机体的多种生理病理过程的调控。目前发现的雌激素受体包括两种亚型,ERα和ERβ。二者分别由不同的基因编码:ERα和ERβ的基因分别位于6号染色体和14号染色体。
- 这两个受体ERα和ERβ包含三个功能结构域
- 氨基末端结构域N-terminal domain,NTD
- DNA结合结构域DNA binding domain,DBD
- 羧基末端配体结合域C-terminal ligand binding domain
- ERα和ERβ的氨基酸一级序列具有较高的同源性,而且ERα和ERβ与配体结合后的空间结构也是差别微小,高度相似。ERα和ERβ的信号传递机制也很类似(具体见下)。
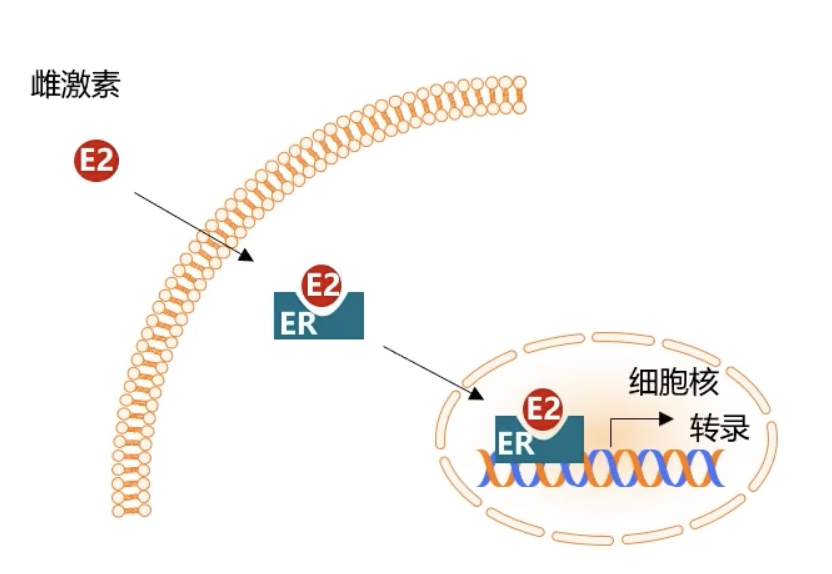
- 雌激素通过扩散进入细胞,与核内雌激素受体ER结合,激活形成ER同源或者异源二聚体。激活的雌激素受体会和DNA增强子雌激素应答元件Estrogen response element,ERE序列结合。ER和ERE形成的复合物促使形成转录起始复合物,并诱导下游基因的转录。
- 虽然ERα和ERβ从分子序列到空间结构,甚至信号传递机制都非常类似,但是ERα和ERβ下游介导的基因和基因的功能却有很大的差别。
- 通过基因表达图谱发现ERα主要上调与细胞生长相关基因的表达,而ERβ功能更加丰富,调节与信号传导、细胞周期进展以及细胞凋亡相关基因的表达。
- 更有甚者,ERα的功能和ERβ的功能也是相反的。例如,在乳腺癌细胞中激活ERα,在雌激素存在的情况下,ERα介导了乳腺癌细胞的恶性增殖。但是,在乳腺癌细胞内过表达ERβ,却会抑制肿瘤细胞内的增殖和血管新生现象。
- 进一步的机制研究表明:ERα和ERβ在细胞核内,通过和其他转录调控因子相互结合,形成转录复合物,从而介导下游基因的转录。
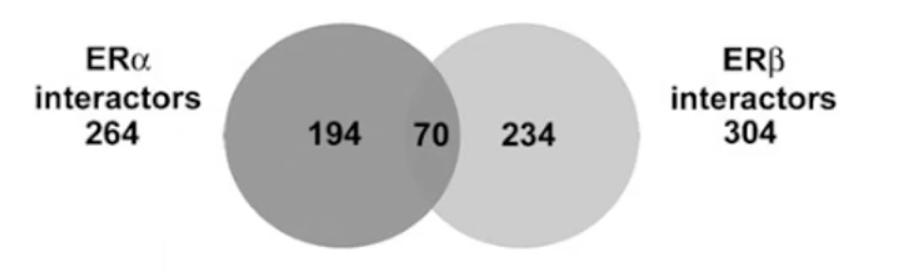
- 蛋白质组学研究发现:能够和ERα相互结合的转录调控因子有264个,而能够和ERβ相互结合的转录调控因子有304个。既能结合ERα,又能结合ERβ的转录调控因子只有70个。换而言之,ERα和ERβ在很大程度上通过招募不同的转录调控因子,形成不同的转录复合物,从而介导不同基因的转录,并且发挥不同的生物学效应。










