使用的文献:Thyroid transcription factor 1 enhances cellular statin sensitivity via perturbing cholesterol metabolism

- 转录因子会结合到下游调控基因的启动子区域或者增强子区域。由于细胞内外信号传导通路的变化,以及结合的转录因子功能的差异,下游基因的表达或者是被激活或者是受到抑制。根据目前的研究结果,转录因子可以通过多种不同的途径调控下游基因的转录。
转录因子的翻译后修饰机制
- 转录因子可以被磷酸化,影响下游基因的转录。
- 在高等动物细胞内的信号调控通路中,细胞刺激信号会导致磷酸化介导的一系列蛋白质的激活,当然也包括转录因子。由于转录是一个非常复杂的过程,需要转录因子和很多其他因子之间的相互协调、相互配合才能完成,因此,转录因子的这种翻译后修饰的变化,可以改变转录复合物的组装特性,从而调节下游基因的转录起始过程。
举例:SMAD家族受到的磷酸化调控
- 在高等动物的细胞内,转录因子的磷酸化修饰会影响异源多聚体复合物的形成,一个很好的案例是SMAD家族成员的磷酸化调控机制。TGF-β超家族成员中的生长因子可以激活下游的SMAD家族成员,SMAD蛋白家族成员可以因为翻译后磷酸化修饰状态的改变,从而影响家族成员彼此之间的结合特性。
- SMAD3和SMAD4蛋白的沉淀平衡和速率研究结果表明,蛋白的磷酸化状态会影响SMAD3和SMAD4蛋白之间,形成同源寡聚体或异源寡聚体的方式。未磷酸化的SMAD3会倾向于形成同源多聚体。在研究磷酸化对SMAD3影响的时候,研究人员将磷酸化位点替换为谷氨酸残基,从而模拟SMAD3的磷酸化状态。在沉淀实验当中,模拟磷酸化的SMAD3分子,同样会形成同源的寡聚体,但是它的结合强度和稳定性是未磷酸化SMAD3的25倍。
- 其次,SMAD3和SMAD4蛋白混合之后,会倾向于形成异源寡聚体。
- 功能学研究发现,SMAD3磷酸化状态的变化对于SMAD3和SMAD4之间异源寡聚体的形成具有非常重要的影响。SMAD3分子一共有三个磷酸化位点,但是只有其中的两个位点磷酸化状态的改变,才会影响SMAD3的功能。SMAD3的磷酸化状态发生变化,SMAD3和SMAD4所形成的异源寡聚体的稳定性会受到影响。更重要的是,由于异源寡聚体稳定性的改变,可以导致下游基因转录调控能力的变化,可能会引起下游整个转录调控网络的改变。因此,SMAD3磷酸化状态的变化,SMAD3和SMAD4之间异源寡聚体的稳定性变化,以及受到SMAD3和SMAD4异源寡聚体调控的下游基因转录的影响,共同组成了一个对于下游基因调控网络的复杂调控模式。
总结:磷酸化影响SMAD3和SMAD4的寡聚化
- 未磷酸化SMAD3倾向于形成同源多聚体
- 磷酸化SMAD3结合强度和稳定性增强
- SMAD3磷酸化状态的变化,影响SMAD3和SMAD4之间异源寡聚体的形成
平台效应
平台效应的定义
简洁版
- 转录复合物的组装具有一定的顺序性
- 平台效应:第一个和DNA结合,并且形成了蛋白-DNA复合物的转录因子,是后续其他转录因子发生结合和相互作用的平台
完整版
- 参与转录起始和转录调控过程的是一个由多种蛋白所形成的复杂的蛋白复合物。这种复杂的蛋白复合物并不是凭空形成的,而是以DNA为模板进行蛋白复合物的组装。
- 通常情况下,蛋白复合物都是由不同的转录因子和转录调控因子所组成。在没有DNA的情况下,这些不同的转录因子和转录调控因子往往不会相互结合,也不会形成蛋白复合物。而且还发现,有些转录因子和DNA之间的结合力非常的弱。结构生物学和热力学研究发现,这种转录蛋白复合物的组装是有一定的顺序性的。首先是某个特定的转录因子,先结合到DNA上,然后其他的转录因子才能再结合到这个已经形成的蛋白DNA复合物之上,最终形成功能完备的转录蛋白复合物,完成基因调控的功能。
- 因此,第一个和DNA发生结合,并且形成蛋白DNA复合物的转录因子,就成为了后续其他转录因子发生结合和相互作用的平台,这就被称为平台效应。
举例:Oct1/2-Bob1复合物
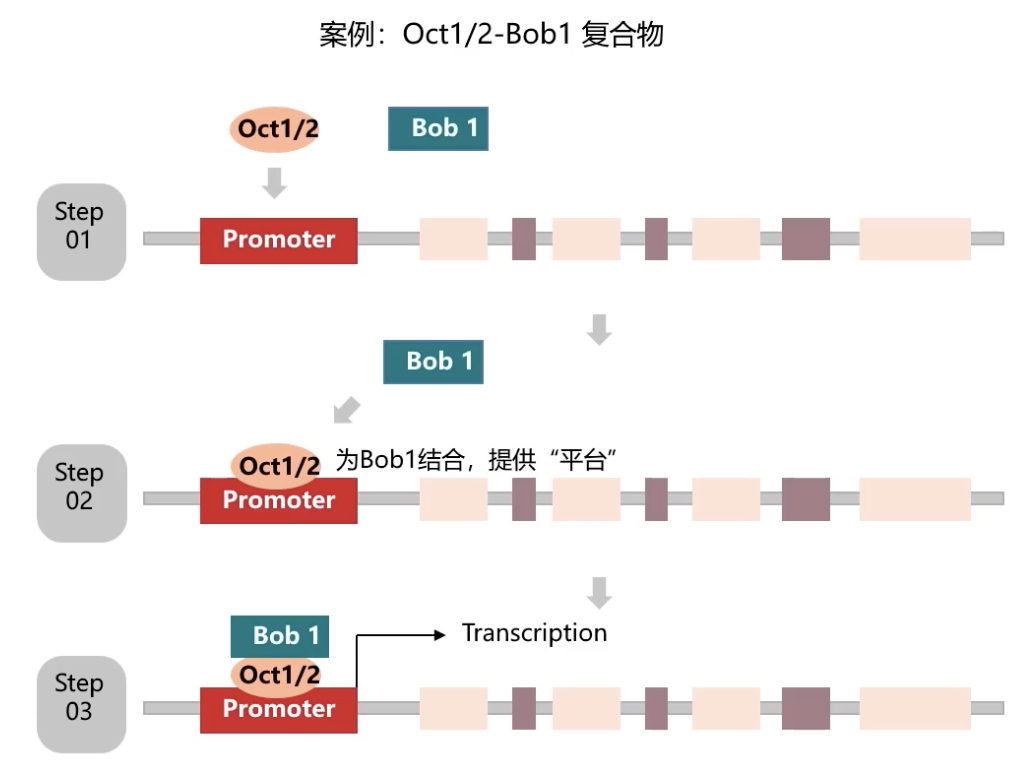
- 这个复合物主要介导了组织特异性免疫球蛋白基因的表达调控。
- Oct-1和Oct-2都属于含有POU结构域的转录因子家族成员。Oct-1或者是Oct-2能够和另外一个蛋白Bob1相互结合,从而在B细胞内影响组织特异性的免疫球蛋白基因的转录调控过程。
- 在Bob1结合到DNA的序列上之前,需要先有Oct-1或者Oct-2先结合到DNA上面,从而形成Oct与DNA的蛋白核酸复合物。只有在Oct-1或Oct-2结合到DNA序列上之后,Bob1才能够继续发生结合,最终形成Oct-Bob1-DNA的三元复合物。
- 结构生物学的分析也证实,Bob1参与介导的是蛋白蛋白相互作用,也就是Bob1和Oct-1/2之间的相互作用,但是Bob1不直接参与和DNA的相互结合。所以在整个结合过程中,Oct-1或者Oct-2就起到了平台效应的作用。
转录因子重新定位蛋白结合的方向
- 在这种机制中,转录因子可以影响蛋白的重定位,也就是reorientation,从而调控下游基因的转录过程。
举例:Jun-Fos-NFAT复合物
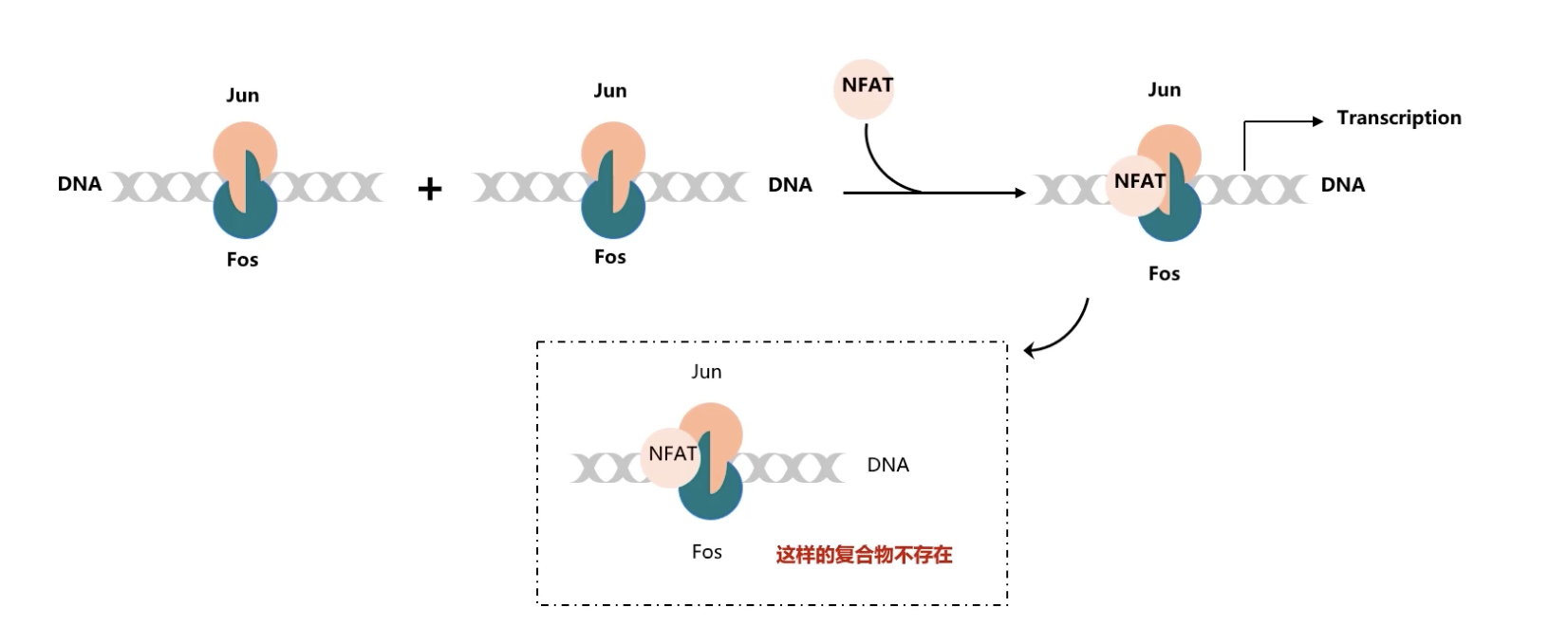
- Jun-Fos异源二聚体参与控制有丝分裂信号调控之下的很多基因的转录调控。Jun和Fos都属于转录因子家族Basic Leucine Zip也就是亮氨酸拉链结构域转录因子家族成员。
- 这两个转录因子中含有亮氨酸拉链结构。这个亮氨酸拉链结构最显著的特征是含有7个亮氨酸残基的重复序列和一些疏水性的氨基酸残基,并由此形成一个ɑ-螺旋。由于Jun和Fos都含有这种ɑ-螺旋结构,因此它们之间可以通过ɑ-螺旋结构从而形成相互平行的卷曲螺旋结构coil-coil,进而形成二聚体。其中,二聚体的卷曲序列可以直接和DNA相互结合。
- 通过结构生物学的细致研究发现,Jun和Fos形成的二聚体在和DNA相结合时有两种方向性,而且只有Jun和Fos的情况下,这两种方向出现的概率是相同的,没有明显的偏好性。
- NFAT全称是活化T细胞核因子nuclear factor of activated T cells。它也是一类转录因子,可以通过和Jun、Fos异源二聚体相互协同作用,从而调控细胞因子基因的转录过程。NFAT Jun、Fos形成的转录因子三聚体和DNA的结合力要明显地强于NFAT和DNA之间或者是Jun-Fos和DNA之间的结合力。结构生物学的研究还发现,在NFAT、Jun、Fos形成三聚体的复合物中,只能观察到Jun、Fos二聚体的一种结合方式。
- 基于上述的研究结果,第一,Jun、Fos二聚体和DNA结合有两种方向。第二,一旦NFAT结合形成NFAT、Jun、Fos三聚体之后,Jun、Fos和DNA的结合只剩下了一种结合方向。因此,一种可能的机制是,NFAT结合了Jun、Fos复合物之后,使得原本随机形成的Jun、Fos复合物的两种方向都会发生重新定向reorientation,从而使得Jun、Fos和DNA的结合只有唯一的一种方向。
- 从转录效率分析,这种由于NFAT结合而重新定向的Jun、Fos复合物的结合方向,它所介导的转录活性比另一种结合方向的转录活性要高得多。换而言之,在和DNA结合时,Jun、Fos二聚体可以自发地形成两种方向,但是NFAT结合后,Jun-Fos只会采取转录效率高的方向,从而提高了对于下游基因的转录能力的调控。
- NFAT介导的Jun-Fos复合物的重新定向机制目前还不是特别明确,只知道在NFAT介导的重新定向过程中,并不需要Jun-Fos二聚体从DNA序列上的解离。
转录因子影响基因组内组蛋白的乙酰化状态,间接调控下游基因的转录
- 我们之前提到的转录因子调控下游基因转录的机制,例如转录因子自身的磷酸化状态、平台效应或者重新定位的机制,这些机制要能够顺利进行,前提都是转录因子可以结合到基因的启动子区域,或者是其他的转录调控区域。而基因的启动子和转录调控区域是否暴露,是否能够让转录因子结合,这本身就是一种基因转录的调控方式。
- DNA序列在细胞核内并非单独存在,146bp的DNA序列缠绕在一个组蛋白形成的核心八聚体上,从而形成一个核小体。这个核心八聚体是由四种核心组蛋白(H2A,H2B,H3和H4)的各两个单位所组成。核小体和核小体之间有20bp的DNA序列相连,从而形成串珠状结构。
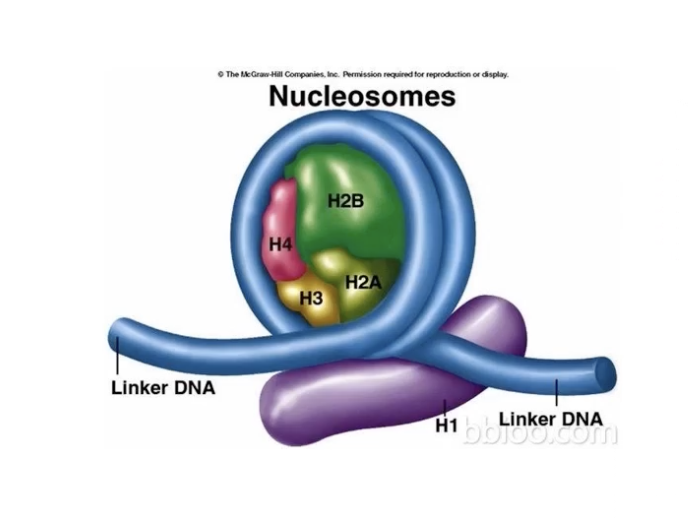
- 核小体中的组蛋白N末端氨基酸大多是非结构化的,含有很多的赖氨酸残基和精氨酸残基,可以受到多种形式的修饰,包括磷酸化、甲基化、泛素化、乙酰化等等,其中组蛋白的乙酰化对于下游基因的转录调控具有最重要的影响。组蛋白N末端的乙酰化修饰可以通过两种途径影响下游基因的转录:
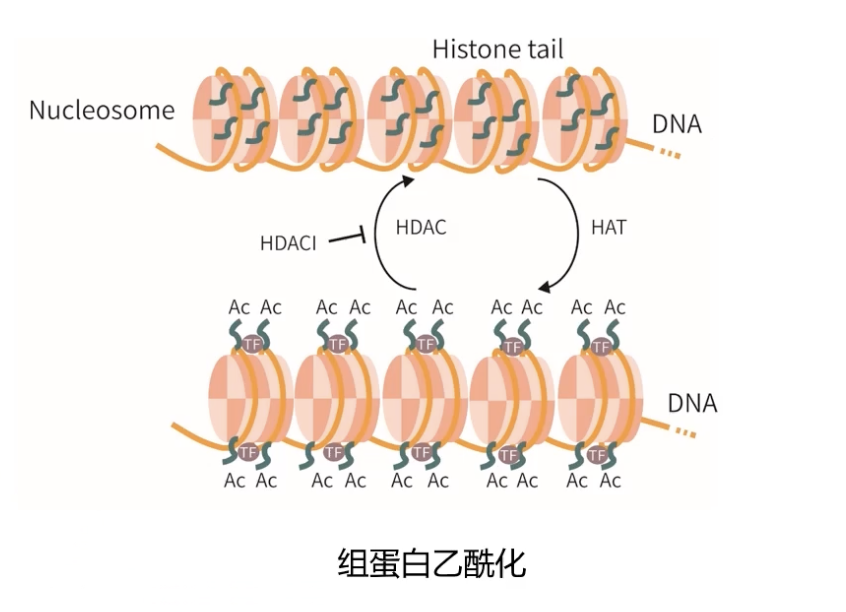
- N末端的乙酰化修饰会形成大量特殊信号,可以供其他蛋白质因子识别,与其他相关蛋白质或者转录调控因子的活动相互影响,形成复杂的网络,参与调控基因的转录过程。
- 组蛋白是碱性蛋白,通常带正电荷,能够与带负电荷的DNA分子结合,从而遮蔽了DNA序列,并阻碍了基因的转录。然而组蛋白在发生乙酰化修饰之后,组蛋白所带的电荷被中和,影响核小体内DNA和组蛋白之间的结合强度。减弱DNA和组蛋白之间的结合,暴露DNA序列,让基因更容易获得转录因子的调控。
- 调控组蛋白发生乙酰化过程的分子被称为组蛋白乙酰转移酶。
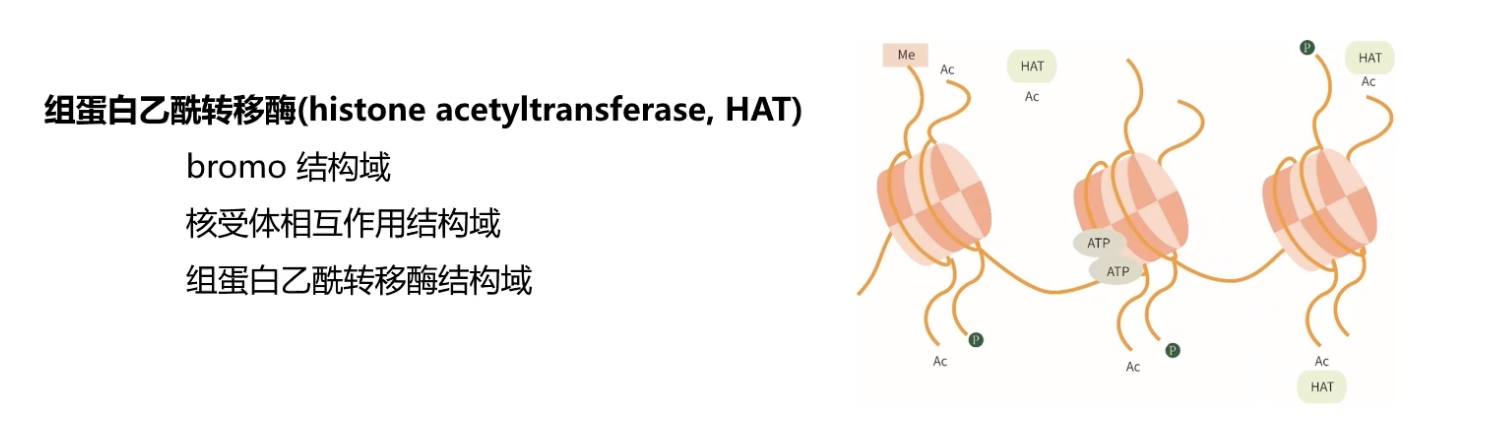
* 组蛋白乙酰转移酶在多种组织细胞内都普遍存在,具有一定的结构相似性,它们都具有bromodomain,核受体相互作用结构域,以及组蛋白乙酰转移酶结构域。
* 组蛋白乙酰转移酶通常不是单独介导下游基因的转录,而是需要和其他因子相互协同发挥作用,改变染色质的结构,从而激活下游基因的转录。
* 对于组蛋白乙酰化激活转录的具体机制,通常认为组蛋白是一类碱性蛋白,带有正电荷。当组蛋白乙酰转移酶对组蛋白的N末端赖氨酸进行乙酰化修饰之后,中和了组蛋白的正电荷,从而减少组蛋白和带有负电荷DNA骨架的亲和性,引起启动子周围染色质构象的变化,而染色质构象的改变使得相关的DNA序列,例如启动子、增强子等区域,获得了暴露,于是转录因子更易于和DNA序列相互结合,更易于启动下游基因的转录。
- 和组蛋白的乙酰化过程相反,组蛋白的去乙酰化过程由组蛋白去乙酰化酶HDAC介导。
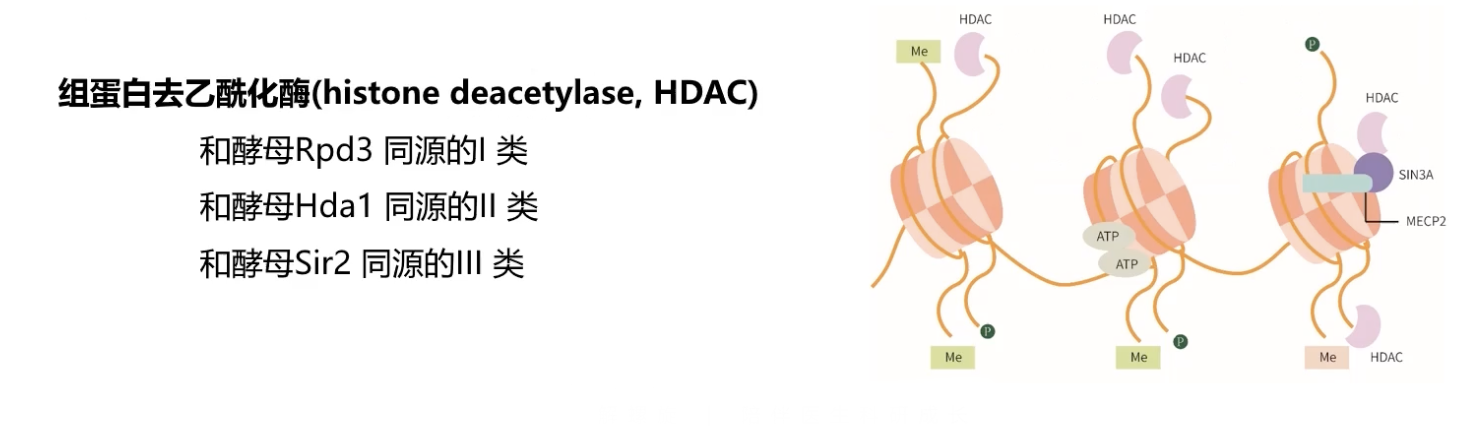
- HDAC分子通常会和一些辅助转录的抑制因子相互结合,形成更大的转录抑制复合物。
- HDAC可以细分为三个家族,和酵母RPD3同源的Ⅰ类,和酵母HDA1同源的Ⅱ类,以及和酵母SIR2同源的Ⅲ类。
- HDAC分子和相关的辅助转录抑制因子形成复合物之后,去除了修饰组蛋白的乙酰化基团,使组蛋白带正电的赖氨酸残基更加暴露,也使得带正电荷的组蛋白和带负电荷的DNA之间相互作用更加紧密,使得基因的调控序列不容易暴露,也不易与转录因子之间的结合,最终导致了基因特异性转录的抑制作用。
- 总而言之,当基因转录过程未被激活时,组蛋白、去乙酰化酶和转录抑制因子相互结合形成复合物,导致染色质压缩和转录抑制。当基因转录过程被激活时,组蛋白乙酰化酶和转录激活因子相互结合形成复合物,并诱导核小体使之处于转录激活的状态。因此组蛋白高乙酰化是基因转录激活的一个标志。组蛋白在转录活性区域被乙酰化,使乙酰化结合的基因处于转录激活的状态,而去乙酰化的组蛋白与转录受抑制的基因区域结合,因此其过程是一个与基因活性诱导和抑制密切相关的动态过程。









