Fig.1当中,作者希望通过一系列的实验,告诉我们CISD2这个基因在胃癌组织中高表达,而在癌旁对照组织中表达很低
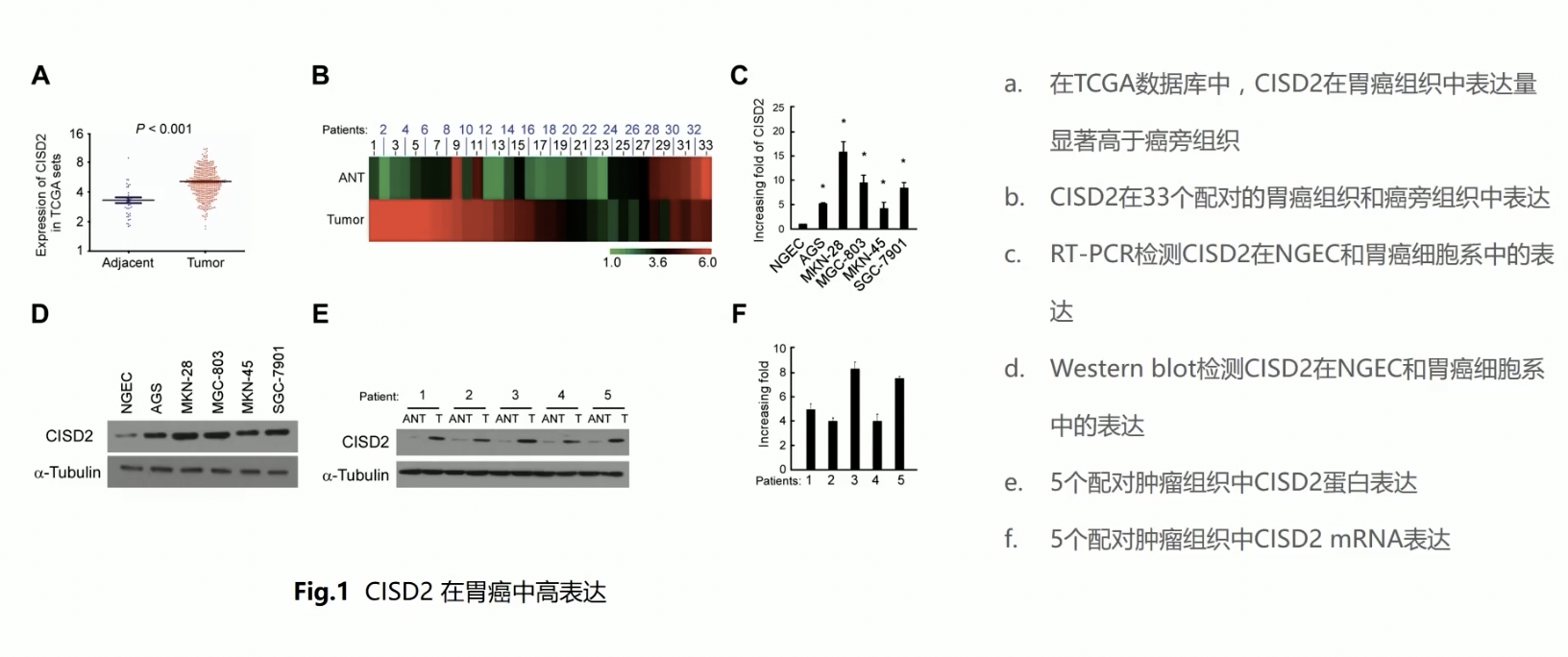
- a图中,作者从TCGA数据库收集了相应的CISD2表达数据,根据作者的报道,作者收集了409例胃癌标本,37例癌旁对照的正常组织标本;通过数据分析,作者发现,CISD2在肿瘤组织中的表达,要显著高于CISD2在癌旁对照组织中的表达
- b图中,为了消除个体的差异性,研究人员挑选了成对的33例组织样本,证实了在这33对组织样本中,CISD2在其中的25例癌组织中高表达,而在癌旁对照组织中低表达
- 随后,作者在c图和d图中,通过qPCR和western,证实了在胃癌细胞系中,CISD2在mRNA和蛋白水平的表达,都比正常细胞的表达要高,因为在后续的研究中,研究者对这个分子做了过表达和RNAi,所以在这里,作者选了两株CISD2分子表达量比较“中庸”的分子进行表达细胞功能学实验
- 在选择细胞株的时候,后续的原则是,如果要做敲减实验,那么就选择细胞株内高表达目的基因的细胞株,反之亦然。对于既要做过表达,又要做RNAi,即可以选择目的基因表达比较一般的细胞株(本文的选择),也可以选择在过表达中选低表达目的基因的细胞株,反之亦然
- e和f图中,作者同样证实了在自己收集的5对临床配对样本中,CISD2的mRNA和蛋白水平在癌组织中的表达,比癌旁组织中的表达更高
- 在Fig.1b中,癌和癌旁之间的比较,正常情况下可以用柱状图来进行表示,但是因为作者选了33对临床组织样本,如果要把这堆样本全都用柱状图来表示,那柱子的数量就太多了,显得整张图非常局促,影响视觉上的效果;作者采用颜色来显示表达,显得图片相对精美一些,这种左图思路值得借鉴
- 在Fig.1a中,作者选择了409例癌组织,但是对应的癌旁组织仅有37例,这是一个非常奇怪的现象,可能引起审稿人的怀疑;建议我们在展示数据时,无论是自己收集的病例,还是从公开数据库下载的病例,都要让对照样本和肿瘤样本在数量上差不多,避免出现相差了几倍,甚至十几倍的现象
作者在Fig.2中研究了CISD2的表达差异与临床预后的相关性
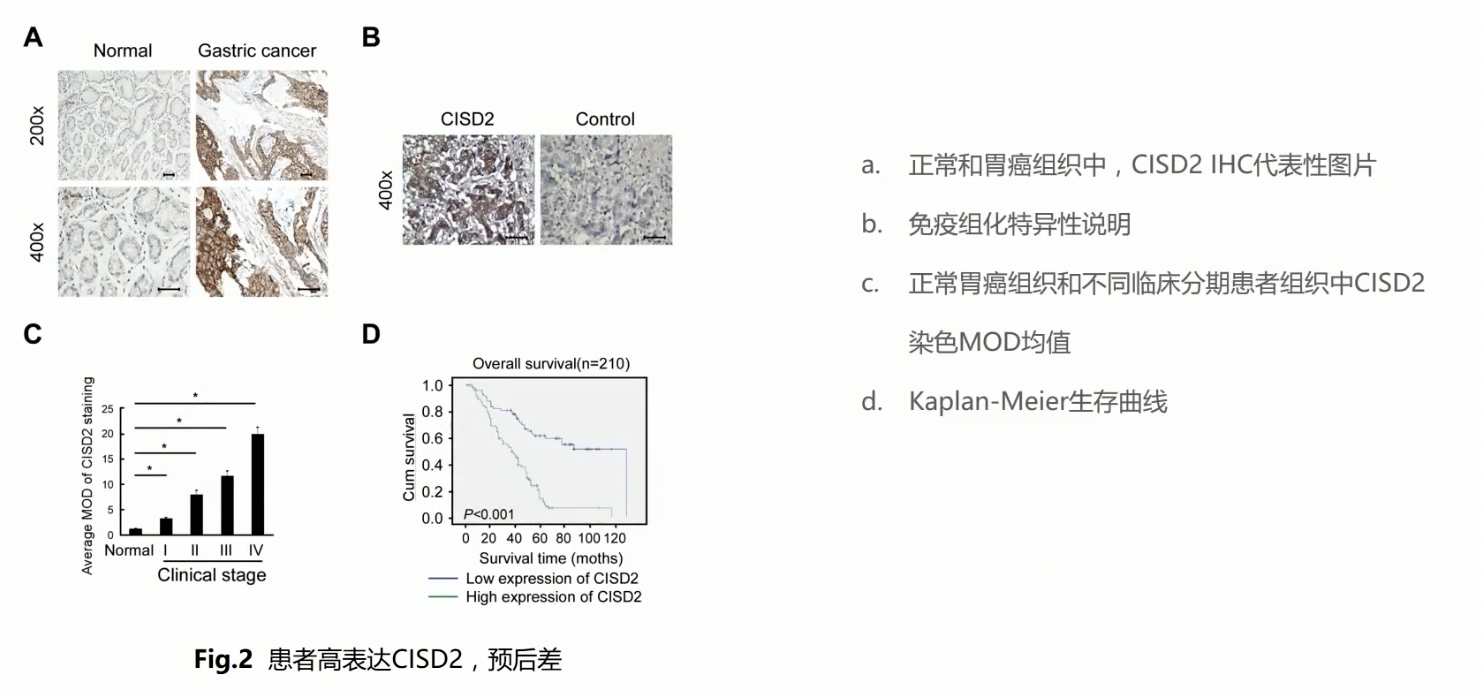
- 作者总共收集了210例石蜡包埋的正常胃组织和胃癌组织的样本,通过免疫组化IHC,在这些胃和胃癌组织上,进行了CISD2的表达检测,IHC的结果显示,CISD2在正常胃组织,或者比较早期的胃癌组织中低表达,在晚期胃癌组织上表达很高,呈现出从正常组织到晚期的胃癌组织,表达不断上升的趋势
- CISD2随着胃癌恶性程度升高而表达增加的趋势,提示了CISD2在胃癌发生过程中可能起到了癌基因的作用
- 图d的生存曲线,作者把患者分成了高表达CISD2组和低表达CISD2,其中高表达CISD2的患者预后显著小于低CISD2组
- 图b是一个体系验证结果,在没有加一抗的条件下,是没有CISD2的阳性结果的;体系验证的结果对文章的证据没有重大影响,完全可以考虑放在补充材料中,而且这张图很可能是审稿人要求作者后补的
- 对于实验结果是应该放在正文中,还是应该放在补充材料中:对于文章的结果导向有重大影响的,应该放在正文中,反之没有重大影响的,放在补充材料中就可以了
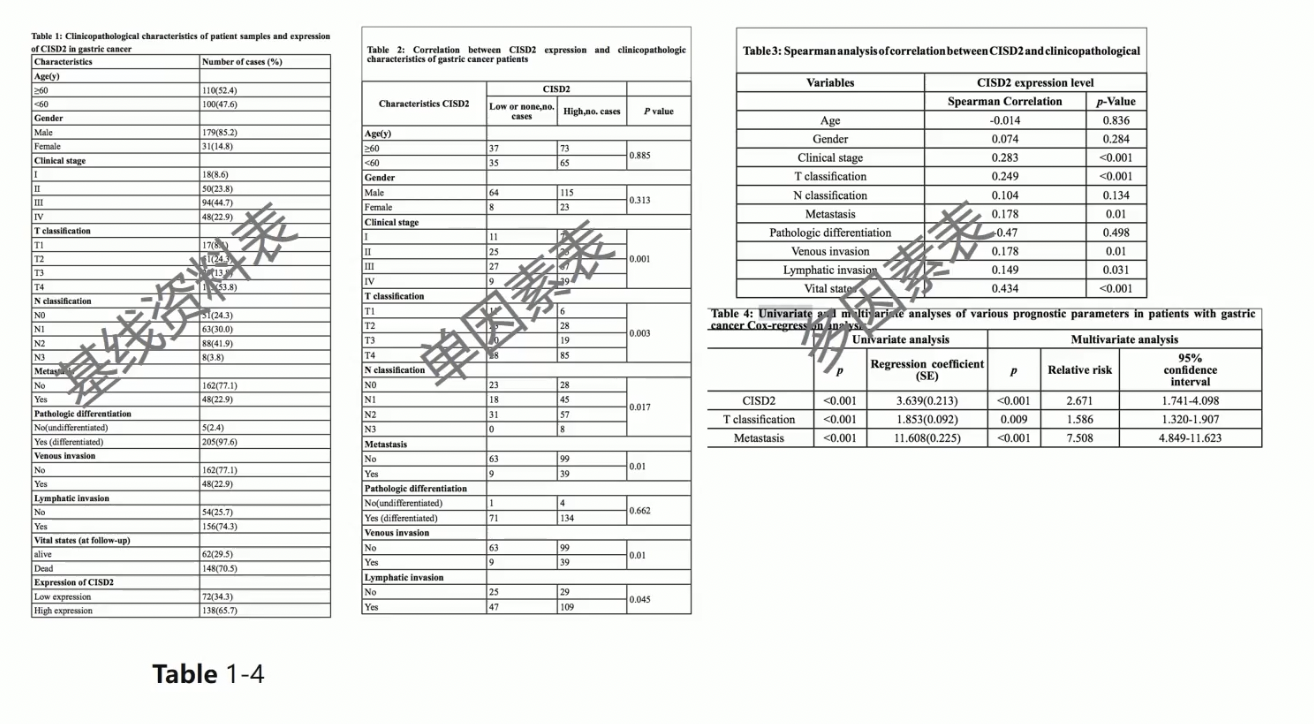
和临床相关的数据表格
基因表达检测
- 基因表达检测的常用方法
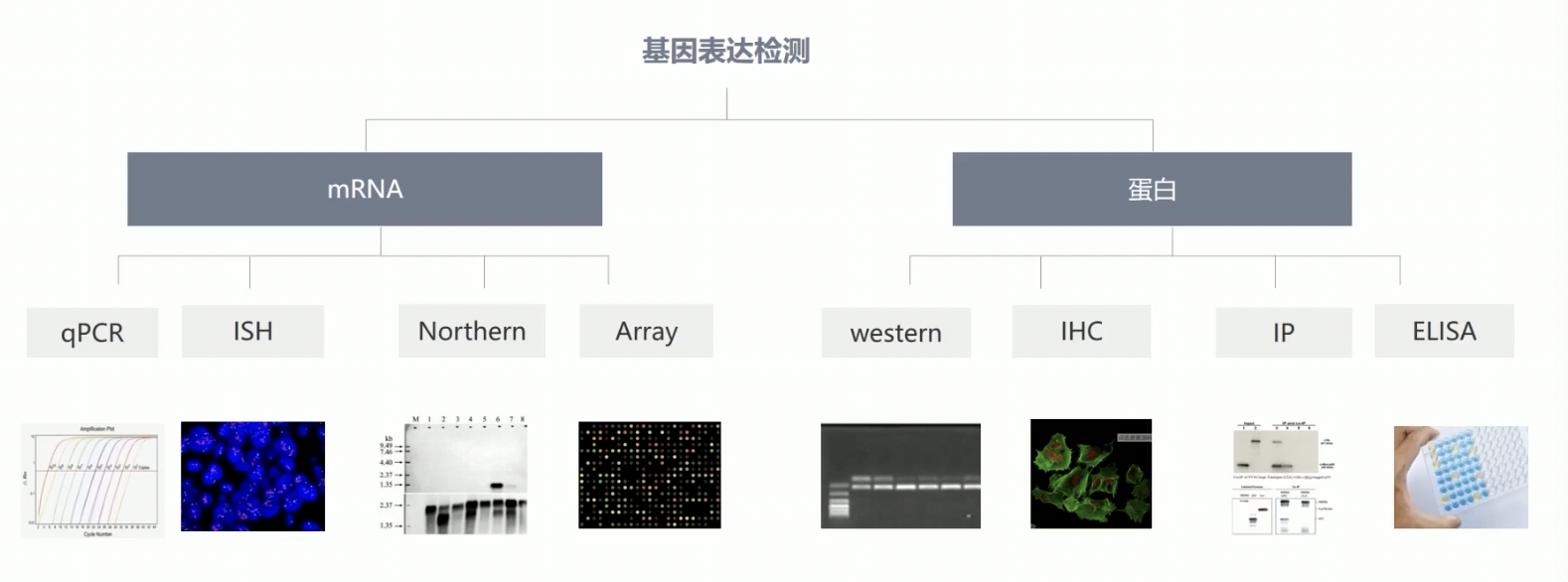
- 作者在检测mRNA水平的内容时,使用了qPCR和基因芯片两种方法,基因芯片没有直接用,但是文章里用到了TCGA数据库下载的文章,这也是基因芯片的内容;其他的方法还有rtPCR(逆转录PCR),这种检查方法只能半定量地观察细胞中基因的表达量;Northern blot的原理是使用与待测序列互补的探针,随后通过检测探针与待测序列互补结合来怕断结果,Northern最大的问题是实验流程长,而且早期的Northern使用放射性同位素,对人的身体伤害比较大
- 在研究tRNA和rRNA时,Northern依然是很有用的方法
- 相比qPCR,Northern的好处是,它可以检测的序列非常长,最多可以到十几个kb的水平
- 对于蛋白水平,作者采用了western和IHC,IHC的好处是可以同时观察到蛋白的表达量和蛋白的亚细胞定位
- 其他检测蛋白质的方法:2D-gel,是同时利用了蛋白质分子大小和所带电荷数的特性,可以更好,更精细地区分不同蛋白质之间的差异
- 免疫荧光也是主流的检测蛋白表达水平的方法,但这篇文章中作者使用的是免疫组化,这俩的原理是一致的,差别在于检测免疫荧光用的二抗有一个荧光基团,可以检测荧光强弱的变化,大部份情况下免疫组化就足够研究蛋白的表达量了,但是,如果要研究共定位的话,免疫荧光具有更大的优势,因为免疫荧光可以进行两种颜色的共定位-双标研究
- ELISA:常用于小分子分泌型蛋白的检测,可以直接取用细胞培养的培养液进行ELISA检测,而且ELISA检测的敏感性也比较高,一般情况下没有必要对培养液进行浓缩
- IP:免疫共沉淀,不是用来检测蛋白的常用方法,但是对于检测某些分子的特殊修饰,比如磷酸化修饰是非常有意义的;对于那些没有磷酸化形式的特异性抗体的,先通过免疫共沉淀的方式把所有的分子都拉下来,无论是磷酸化了的还是没有磷酸化的,然后再这一群拉下来的分子中,再通过泛磷酸化的抗体,检测目的分子
作者在细胞和动物层面研究CISD2对肿瘤细胞表型的影响
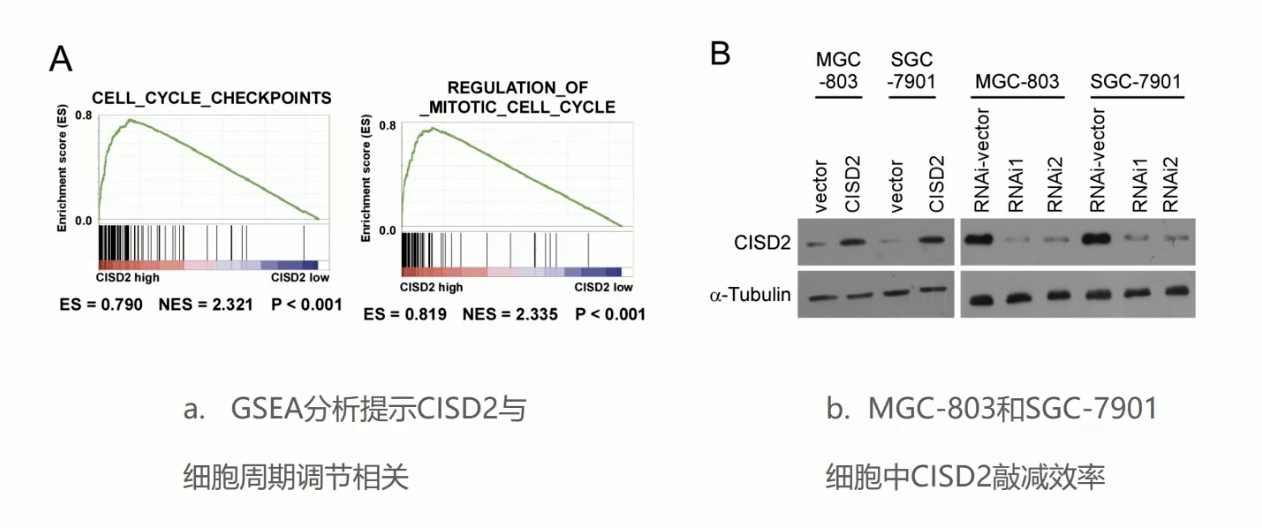
- 作者首先做了GSEA的分析,发现CISD2的表达水平,和细胞周期相关的基因子集具有高度的表达相关性,由GSEA的分析结果,作者可以得到的是CISD2可以影响的是细胞的周期以及分裂
- 为了验证上述假说,作者首先构建了CISD2的过表达质粒和敲减质粒,然后证明了这些质粒都是有用的
- 然后作者通过经典的克隆形成和MTT比色法的实验,分别检测了过表达和沉默CISD2后,细胞增殖以及克隆形成收到的影响,结果显示CISD2过表达的组增殖能力增加,反之亦然
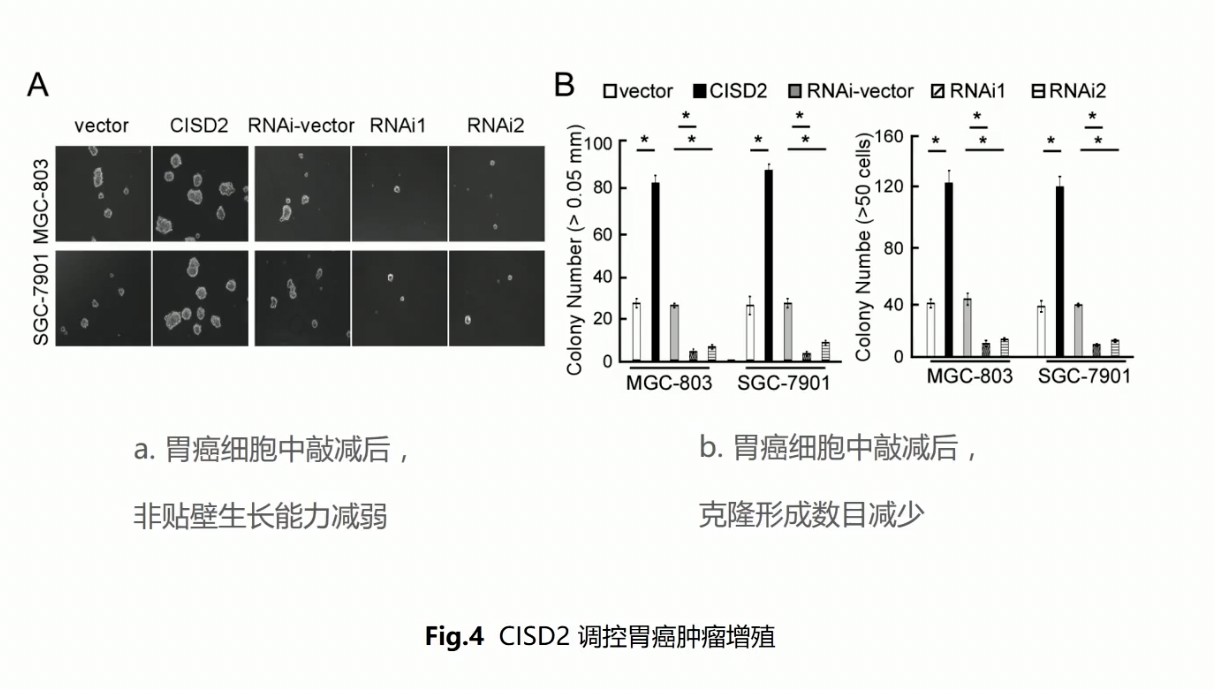
- 在Fig.4中,作者采用了锚定非依赖的增殖实验,这是利用了肿瘤细胞不需锚定基质,就可以进行显著增殖的现象,在肿瘤细胞内提高CISD2的表达水平,肿瘤细胞这种锚定非依赖的增殖能力就获得了极大的提升,反之亦然,这个实验充分说明了表达CISD2水平的高低和肿瘤的增殖能力有直接的相关性
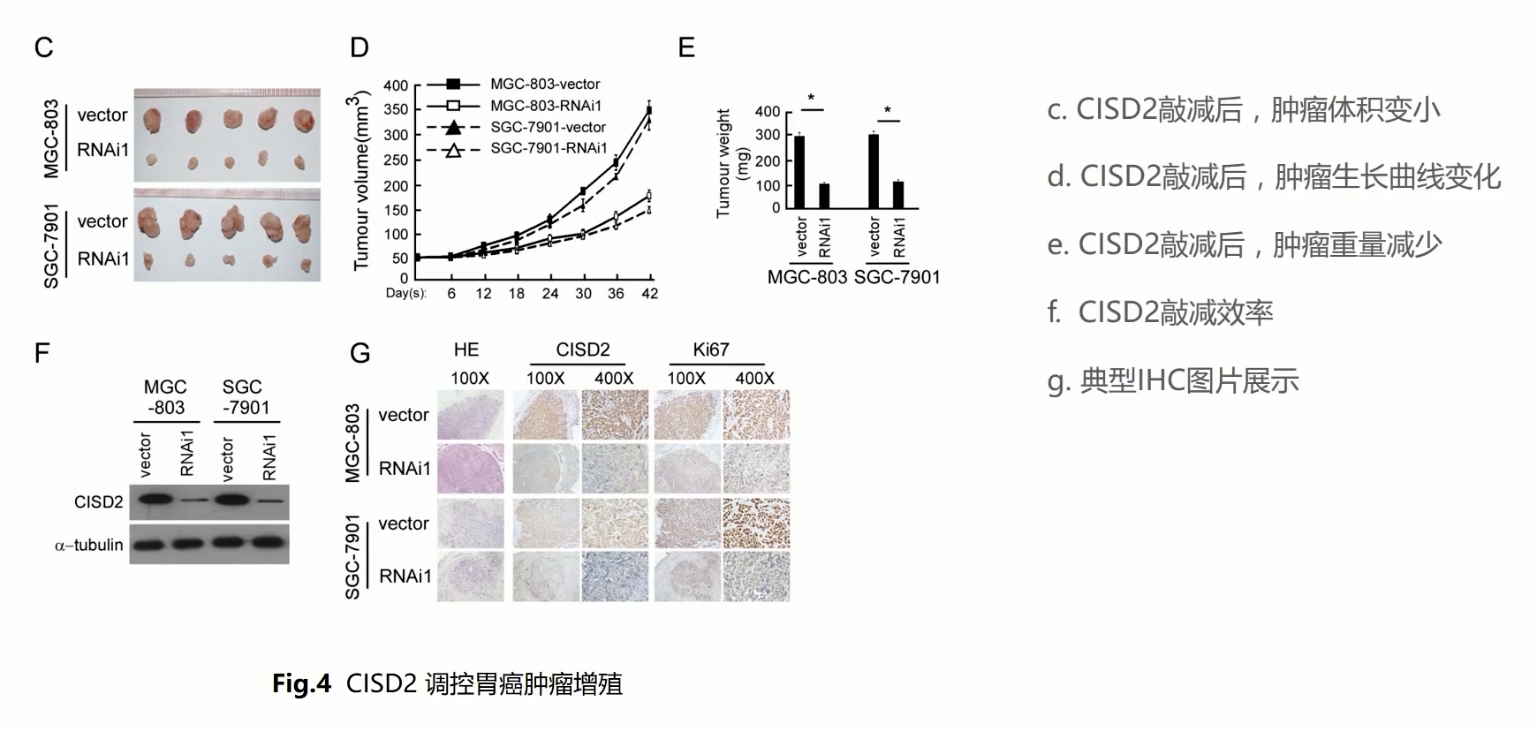
- 在做完了离体的细胞实验后,作者选择了在体的动物实验,但是只做了CISD2敲减情况下的动物模型验证,敲减CISD2后,能在小鼠体内形成的肿瘤组织体积会明显减小,重量也减轻了
- 在移植瘤实验结束后,获取移植瘤匀浆样本,再进行western检测,发现RNAi的效率可以持续到整个实验的结束
- 通过移植瘤组织进行IHC研究,也可以发现CISD2在对照的移植瘤内高表达,而在敲减的移植瘤内表达明显降低,和CISD2表达高低抑制的,是肿瘤增殖的标志物Ki-67
- 在细胞层面上,作者同时做了高表达CISD2和低表达CISD2两组的结果,但是在动物模型上的研究就只有敲减CISD2的了,这主要是因为动物模型工作量巨大,能够仅通过敲减CISD2这一个实验就证明CISD2的癌基因功能,在一般情况下,审稿人不会过分要求,不是非要在在体层次上重复离体细胞实验的结果
- 作者在本项研究中进行的RNAi方法,不是常规的慢病毒敲减方法,而是逆转录病毒介导的RNAi敲减的方法,因为和慢病毒相比,逆转录病毒只有在细胞分裂的时候才会产生作用,细胞不分裂的时候是无法发挥作用的,慢病毒则不会受到细胞分裂的影响
作者进行机制研究
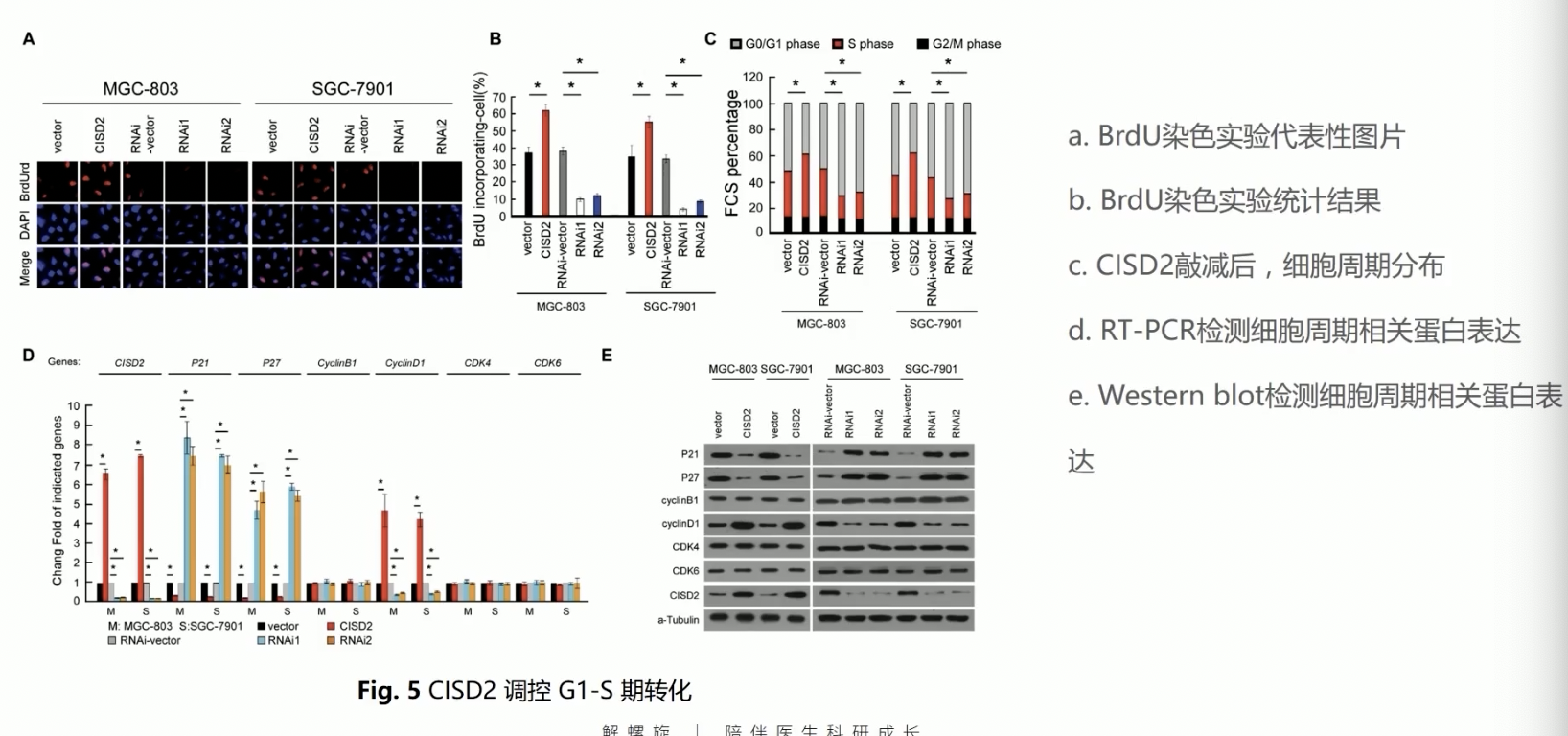
- Fig.5证明了CISD2可以影响肿瘤的细胞周期调控,尤其是影响细胞的G1/S期转化
- 作者首先进行了BrdU染色实验,BrdU阳性的细胞是进行了细胞分裂,且有DNA复制的细胞,实验中总的细胞数可以通过DAPI染色显示,因为DAPI是一种核染料,可以把所有的细胞核都染色
- 在CISD2过表达情况下,BrdU阳性的百分比会显著提升,说明发生细胞分裂和DNA复制的细胞百分比显著上升,反之亦然
- 作者接着通过流式细胞术对肿瘤的细胞周期进行了更加细致的分解,在CISD2过表达的情况下,S期的细胞会有明显提升,相应的G0/G1期细胞比例下降,反之亦然,所以说流式细胞术证明了CISD2调控了细胞G1/S期的转化过程
- 最后,作者通过Fig.5d和5e,从mRNA水平和蛋白水平,验证了和细胞周期相关的,调控分子的表达的高低,作者的实验结果证实,p21/p27/cyclin D1明显收到了CISD2的调控,但是其他分子,如cyclin B1/CDK4/6没有受到CISD2表达的影响
- 作者选这几个分子是因为cyclin D1/CDK4/6是有大量文献证明参与了G1/S期转化的,cyclin B1介导了G2/M期转化,p21和p27是在细胞周期中重要的负调控分子,所以在CISD2过表达的情况下,p21和p27的表达是受到抑制的,反之亦然
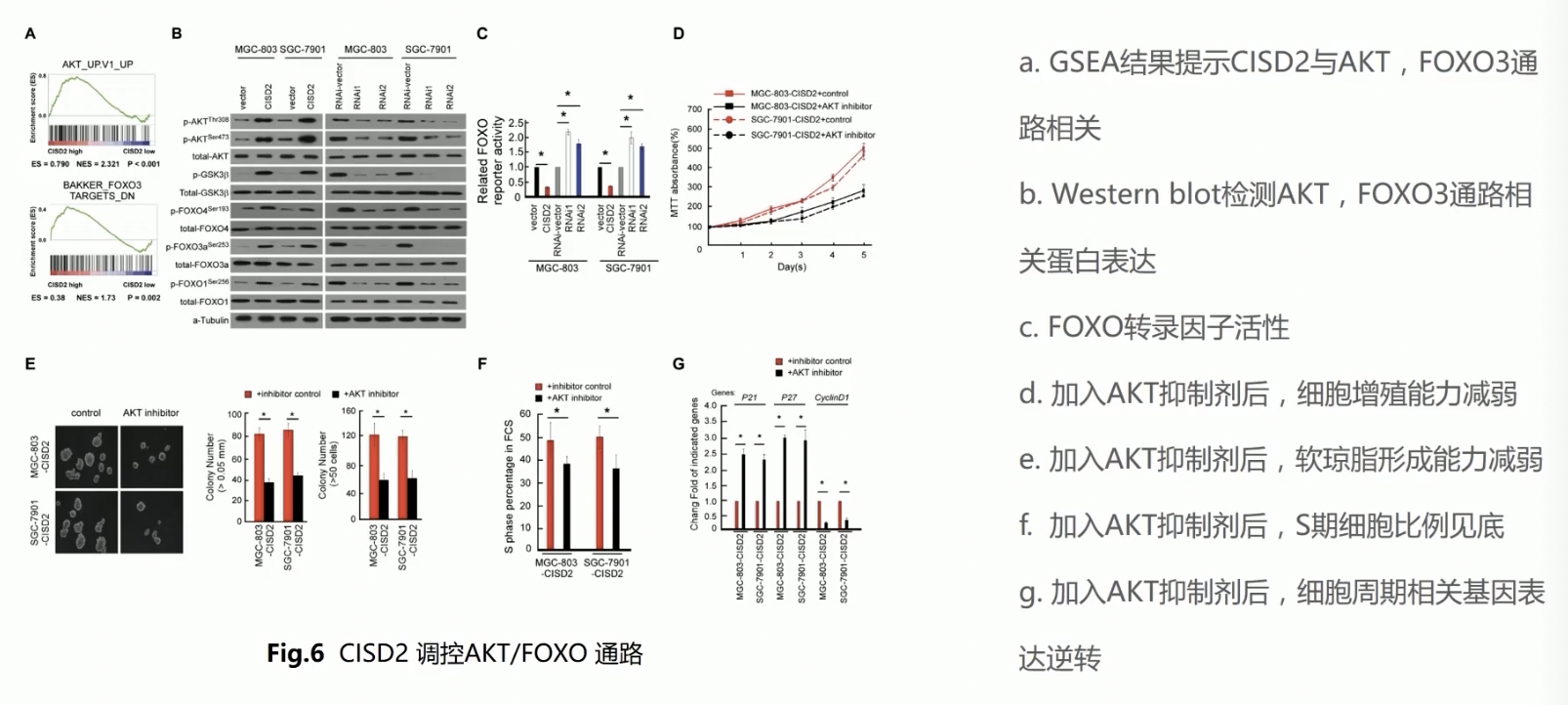
- 通过Fig.5,作者证实了CISD2影响cyclin D/p21/p27,进而影响细胞周期,于是在Fig.6继续对这条信号通路进行了挖掘
- Fig.6中,作者依然首先通过GSEA的分析方法,发现CISD2的表达与AKT,以及FOXO3相关的基因子集之间,有高度的富集现象,所以作者就把研究重点聚焦在了AKT-FOXO信号通路上
- 通过western也证实了,CISD2过表达后,AKT的磷酸化增加了,FOXO、FOXO-1、FOXO-3a的磷酸化都增加了,相反,如果削减CISD2的表达,AKT的磷酸化, FOXO-1、FOXO-3a、FOXO-4的磷酸化水平都会显著受到抑制
- FOXO家族的4个成员是:FOXO-1、3、4、6,在这个实验中作者只检测了FOXO-1、3、4,没有检测FOXO-6,这里可能引起审稿人的怀疑(为什么不检测FOXO-6,还是FOXO-6的数据做出来不好看,所以没有放上去)
- 一个复习:没有被磷酸化的FOXO才可以进入细胞核内,调节基因的表达;p-FOXO无法进入细胞核,也就是说FOXO的磷酸化水平和其进入细胞核,调节基因转录的能力成反比;在FOXO的磷酸化水平提升后,通过荧光素酶实验可以发现,FOXO reporter activity是明显下降的,这一结果充分证明了FOXO的磷酸化水平和其进入细胞核,调节基因转录的能力成反比
- 在验证完CISD2与AKT-FOXO信号通路之间的相关性后,作者提出一个隐含的假设:CISD2可以调控下游的AKT-FOXO信号通路,同时CISD2也能影响增殖和细胞周期的表型,所以作者的隐含假设是:CISD2通过影响AKT- FOXO信号通路,影响肿瘤增殖和细胞周期表型
- 为了验证这个假设,作者阻断了AKT信号通路,验证CISD2引起的表型,是否可以因为AKT信号通路被阻断而阻断,如果CISD2引起的下游效应很大程度上依赖于AKT信号通路,那么AKT信号通路阻断后,CISD2的下游效应也会消失
- 作者通过MTT比色法和锚定非依赖的增殖实验,以及细胞周期实验,都证实单独过表达CISD2可以显著引起肿瘤细胞的增殖,以及导致锚定非依赖增殖现象的升高,但是只要阻断AKT信号通路,CISD2引起的增殖就会受到抑制,锚定非依赖的增殖效应也会受到抑制,发生S期周期阻滞的细胞比例下降,这些结果都证明,CISD2确实通过AKT信号通路,介导了肿瘤细胞的恶性增殖表型
- 最后,作者证实了,在使用了AKT抑制剂之后,p21/p27的表达都是显著升高的,而cyclin D1的表达是显著降低的
- Fig.6主要证明了CISD2的下游效应是依赖AKT信号通路的,但是整个实验的逻辑不够严谨
- 通过之前的实验,作者证明了CISD2可以影响细胞的周期和增殖表型,CISD2可以调控AKT-FOXO信号通路,所以作者自然而然就会形成一个思路,也就是CISD2通过AKT-FOXO信号通路,介导了肿瘤增殖和细胞周期表型
- 但是,作者为了阻断AKT-FOXO信号通路,选择的是AKT的抑制剂,这里的问题是AKT下游介导的信号通路是非常复杂的,FOXO只是其中一个信号分子,还有mTor,VEGF-MAPK,NF-κB,甚至是AKT直接抑制p21/p27,所以很难解释Fig.6g中,AKT被抑制剂抑制后,细胞中p21/p27表达升高到底是因为什么(AKT直接影响p21/27,还是AKT通过FOXO间接性影响p21/27)
- 所以,如果要验证AKT-FOXO的功能,选择FOXO的抑制剂可能比选择AKT的抑制剂更好



