来源:BV1qa411A7Uw
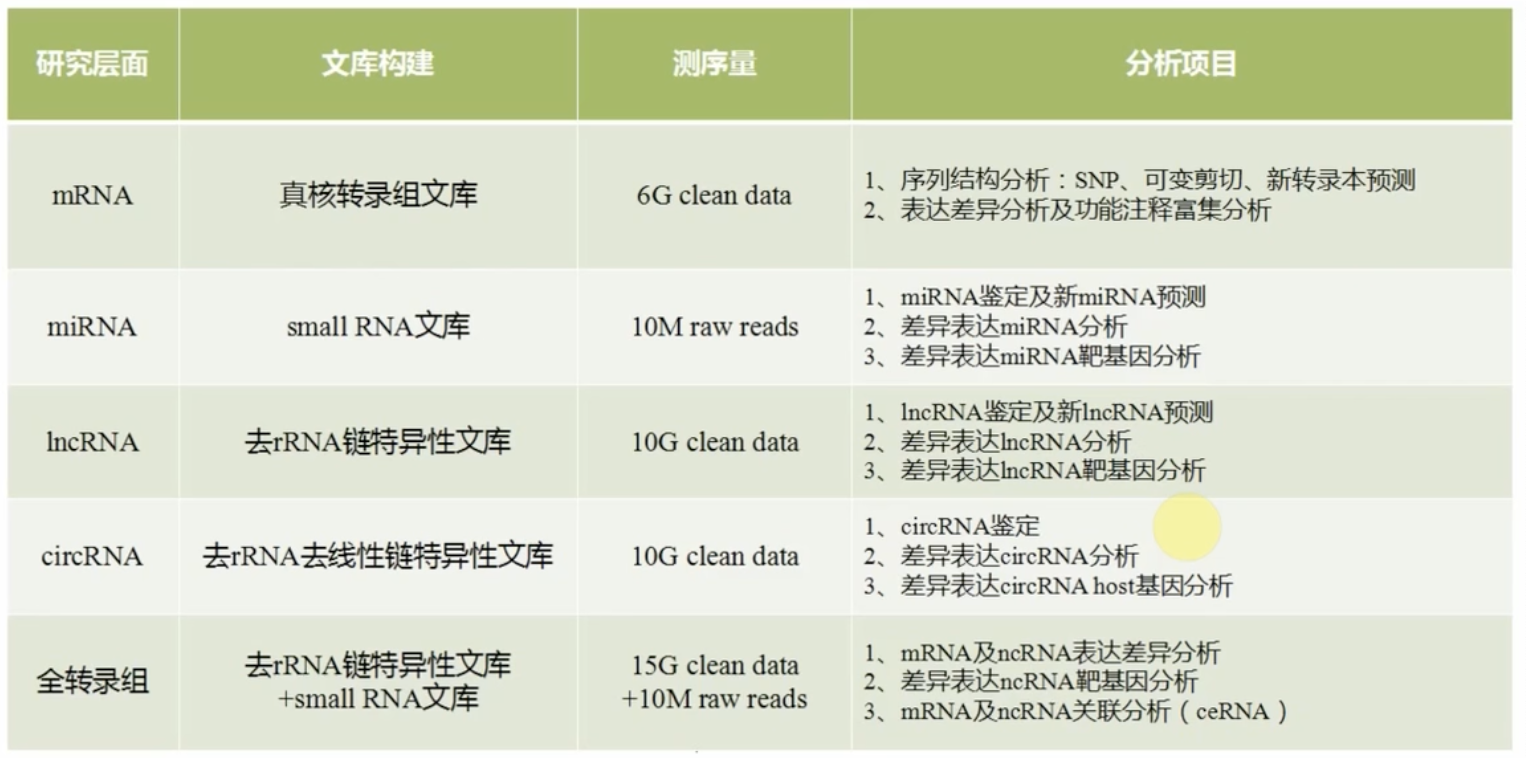
转录组简介
- 中心法则
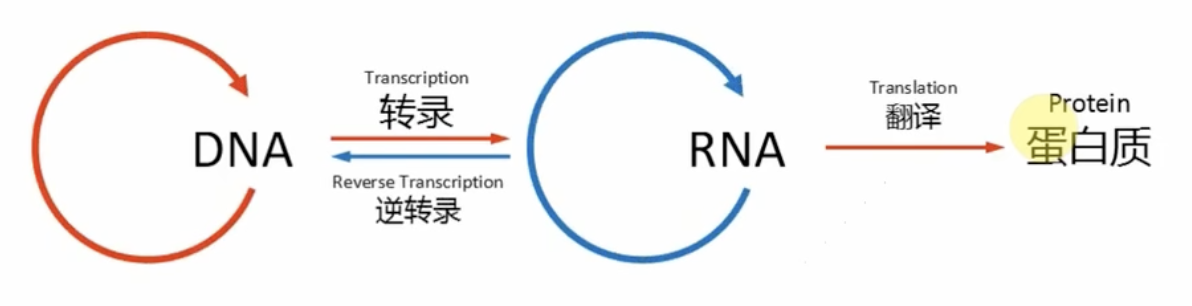
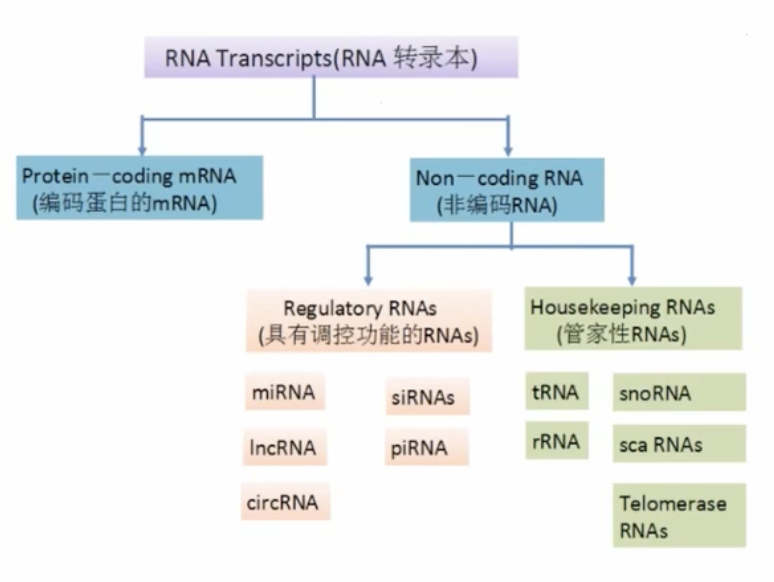
- 转录组是特定物种、组织或细胞在特定生理状态下转录的所有RNA的集合,包括mRNA和非编码RNA(Non-coding RNA)
- 转录组测序能够快速获得mRNA表达谱;根据测定的序列同时可以对SNP、可变剪接等转录本的序列及结构信息进行精确地分析。
- 此外,通过不同的文库构建策略,转录组测序能够发现大量的ncRNA,并且对其表达水平和转录本结构进行分析;当进一步开展ncRNA与mRNA的关联分析时,就可以深入研究ncRNA的调控网络(ceRNA)
各种RNA在医学研究中被关注的顺序

- miRNA序列较短,21-24nt
- lncRNA序列较长,>200nt
- circRNA:环状RNA
ceRNA假说
- ce-competing endogenous
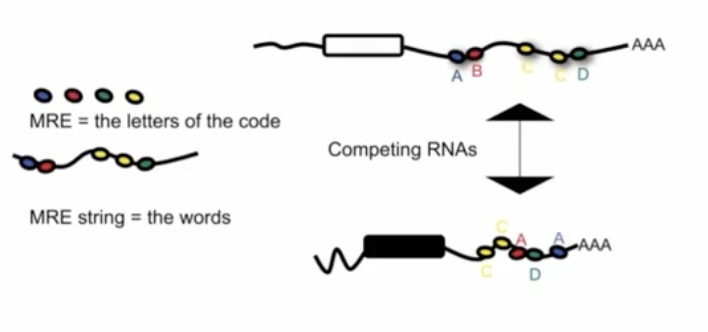
- 白色的方框——真基因;黑色的方框——假基因
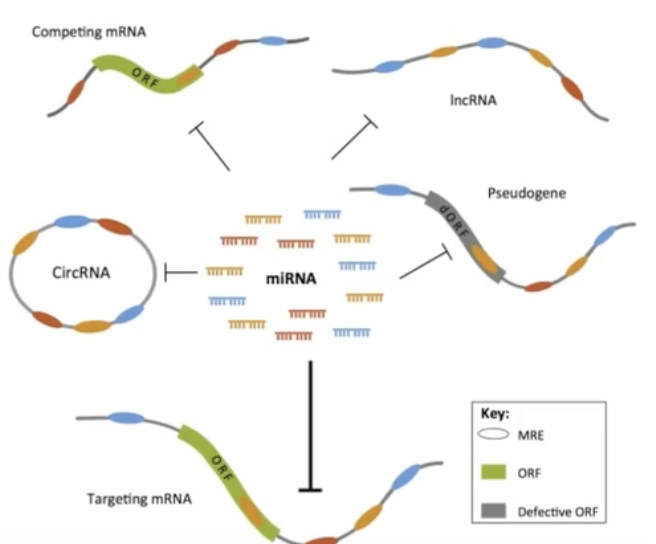
- 具有相同miRNA应答元件,即MRE的mRNA,假基因转录物和lncRNA等转录物通过竞争性结合同种类的miRNA来调控各自的表达水平,进而影响细胞的功能
转录组在医学研究中的应用
生长发育研究
- 胚胎发育、生长发育、衰老死亡
- 通过转录组测序可以找到不同生长发育阶段、不同成长条件、不同组织器官显著差异表达、特异表达的mRNA和非编码RNA,通过进行功能注释(GO、KEGG等)和富集分析等,可以找到特异的biomarker;同时,通过将mRNA和非编码RNA进行联合分析,还可深入挖掘表型性状背后存在的复杂的分子调控机制。
药理研究
- 药物作用效果和作用机制(靶点)、新药开发
- 通过转录组测序可以研究不同类型、不同剂量浓度、不同作用时间等的药物处理对机体作用情况及其内在的作用机理。通过对显著差异表达、特异表达的mRNA和非编码RNA,通过进行功能注释(GO、KEGG等)和富集分析等,同时,通过将mRNA和非编码RNA进行联合分析,可以研究检测药物对基因表达的影响情况,从而了解药物影响机体代谢和生理病理的情况,为药理学研究奠定基础。
免疫研究
- 免疫反应、自体免疫疾病
- 通过转录组测序可以找到不同病原微生物、异物等引起的机体显著差异表达、特异表达的mRNA和非编码RNA,通过进行功能注释(GO、KEGG等)和富集分析等,可以找到关键性作用的免疫功能基因;同时,通过将mRNA和非编码RNA进行联合分析,还可深入挖掘免疫反应背后存在的复杂的分子调控机制。
- 互作转录组(用于分析免疫反应中宿主和病原菌相互反应的分子机制)
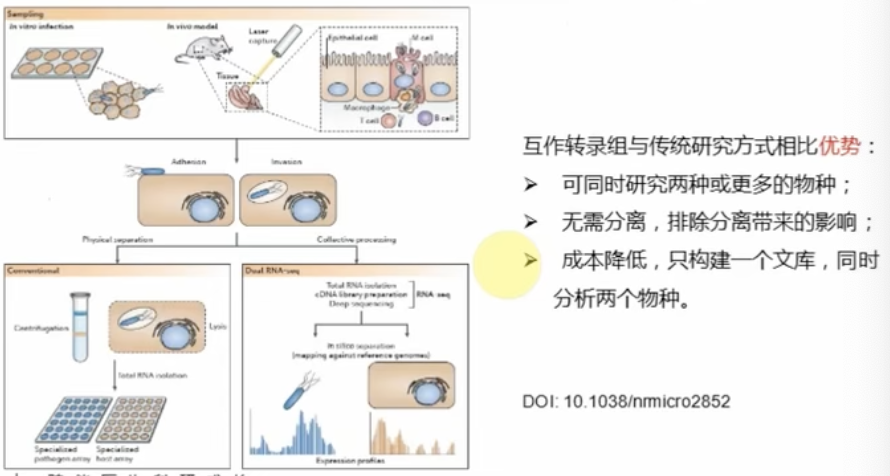
疾病研究
- 肿瘤、代谢性疾病、神经性疾病
- 通过转录组测序可以获得肿瘤发生发展过程中相关基因mRNA和非编码RNA的结构变异情况、表达差异情况和特异性表达情况,研究肿瘤发生和发展的分子机制,鉴定biomarker,协助疾病诊断、疾病监控和治疗以及药物靶点研究、药物开发等。
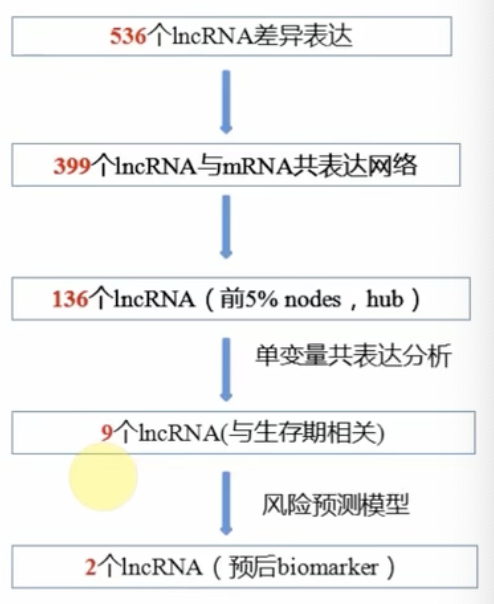
- 举例:在卵巢癌中,通过lncRNA-mRNA共表达分析鉴定与免疫相关的lncRNA生物标志物
- 对399个卵巢癌患者取样,通过hncRNA-mRNA共表达网络分析,鉴定出两个IncRNA(RP11-284N8.3.1 andAC104699.1.1)不仅在卵巢癌发展过程中表达具有差异性,而且能预测不同发展时期病人的预后;
- 进一步发现这两个IncRNA在IncRNA-mRNA regulatory network (OVL.MI)中位置临近,推测共同调节病人的发展阶段。
- 功能分析发现这两个IncRNA在免疫系统的活化和抗肿瘤过程中发挥作用,子卵巢癌模型中这两个IncRNA可以作为病人病情发展阶段的评估标志物。
- 该两个hcRNA可以作为患者的潜在生物标志物,为靶向药物开发提供理论依据。
外泌体
- 外泌体exosome,是细胞分泌的大小为30-100nm的微小囊泡,具有脂质双层膜结构,广泛存在于所有体液中,包括血液、唾液、尿液和母乳等。
- 研究发现,外泌体包含多种活性分子,如蛋白质、脂肪和核酸(mRNA、miRNA 及其它非编码 RNA)等,能作为信号分子传递给靶細胞,从而介导细胞间的物质传递与信息交流。
- 早期这种小囊泡被认为是一种细胞废弃物,有关其研究进展缓慢。近年来,外泌体已成为科研热点,其在临床上巨大的应用价值,引起了众多研究者以及商业人士的浓厚兴趣。随着相关技术的发展,有关外泌体在临床的诊断、治疗及预后中的应用研究正在蓬勃开展。
- 目前,外泌体在癌症的诊断、治疗及预后中的应用已成为研究热点,其在生物标记物、肿瘤转移、药物载体和靶点、免疫、心脑血管、损伤修复等多个领域取得了突破性进展。
- 举例:一项以外泌体为抓手,研究缺氧与肿瘤转移相关因素的研究
- 前期实验
- 检测外泌体是否存在:电子显微镜+外泌体表面marker
- 缺氧OSCC细胞外泌体影响正常细胞的侵袭和迁移:细胞划痕实验+肿瘤细胞侵袭实验
- 外泌体miRNA测序(关注目标miRNA)
- Rfam数据库比对
- 样本间miRNA差异表达分析
- 后期验证
- 敲除实验
- 裸鼠皮下注射实验
- 过表达实验
- EMT信号通路实验
- 临床——与临床病理参数相结合
- 前期实验
实验设计要点
根据差异设计实验
样本差异
- 样本个体组成
- 年龄
- 性别
- 发育、病情阶段
- 遗传背景
- 样本类型差异
- 组织器官
- (单)细胞
- 血液
- 外泌体
处理差异
- 处理方式差异(横向)
- 物理(理疗)
- 化学(药剂)
- 生物(病原菌)
- 处理方式的内容差异(纵向)
- 浓度、剂量梯度
- 时间梯度
根据实验设计取样
注意事项
- 实验组的生物学重复一般建议至少5-10个,一个人即为1个重复
- 对照组的生物学重复可以稍微比实验组少一些(同病不同症状)
- 取样的注意事项
- 随机性:避免系统误差、减少误差来源
- 普遍性:减少个体差异
- 一致性:非实验变量需要保持一致
取生物学重复的意义
- 减少组内个体差异的干扰,体现真实的组间差异
- 评估差异表达基因的可靠性
- 生物学重复的相关性可以辅助筛查异常的样本
- 检验生物学实验操作的可重复性
- 如不设生物学重复,部分杂志可能会因此拒稿
根据目标分子类型设计实验
取样保存注意事项
- 避免RNA的降解,以得到更好的实验效果
实验工具和环境
- 核心思路是去除内源性/外源性的RNAse
- 实验人员须穿好实验服,戴上手套和口罩,所用到的耗材和器皿以及实验区域要在RNA提取前进行RNase清除(高温干热/湿热灭酶、使用 RNA 酶抑制剂)处理

组织取样保存注意事项
- 所有的组织样品都要液氨速冻,-80°C保存
- (如果实验条件不允许),组织样品RNAlater 4°C过夜孵育,-20°C或-80°C长期保存
- 细胞加入裂解液反复吹打至裂解充分,液氨速冻-80°C保存
使用液氮保存组织取样注意事项
- 无酶冻存管在液氮中预先冷冻
- 活体上迅速取下组织,切成黄豆粒大小的块状
- RNAse-free配置1✖️PBS或生理盐水快速清洗组织表面的污渍,吸干表面液体后收集进冻存管,管的下部份保持在液氮中
- 液氮速冻(干冰或低温冰箱的降温速度比较缓慢,不能及时抑制RNAse的活性而引起样本讲解,因此需要在最短时间将样品转移到液氮中保存,彻底冷冻后再转移到-80°C
无液氮冷冻条件的组织取样注意事项
- 仅适用于新鲜组织样本,不适用于已经冷冻保存的组织样本,骨头,以及表面蜡质丰富的植物
- 不建议用RNA later保存液体样本,这两者会发生互溶
- 将新鲜组织切成规定的大小,按照比例加入RNA later中
- 将样本放置于4°C保存过夜,使RNA later完全渗透组织
- 转移到-20°C或-80°C长期保存
- 为避免组织块在运输的过程中露出页面,要将RNA later灌满管子
保存液相关注意事项
- 不建议寄送用裂解液保存的组织样本。除了用trizo/保存细胞的样本外,用裂解液保存的组织样本,无论是研磨好的粉未还是切割好的组织块,所抽提的RNA质量普遍较差。
- RNA later及类似保存液保存的样本,按说明将组织切小块。组织块过大会影响RNA later渗透入组织内部的效率,也会造成RNAlater无法完全覆盖组织,而未被覆盖的组织部位极易被RNase降解。
细胞样本的采集
- 建议送样细胞数>5✖️10^6
贴壁细胞的处理
- 取生长状态良好(对数生长期)细胞,确定细胞数量
- 用1X PBS洗涤细胞,离心弃PBS,洗1-2次
- 加入适量裂解液反复吹打至裂解充分
- 转移至离心管中,-80°C保存
- 按照每10cm^2(相当于六孔版1个孔或35mm直径培养皿)细胞加入1mL Trizol
悬浮细胞的处理
- 取生长状态良好的细胞悬液,确定细胞数量;
- 离心,吸除细胞培养基,1XPBS洗涤,离心弃PBS,洗1-2次
- 加入适量裂解液反复吹打至裂解充分
- 转移至离心管中,-80°C保存
- 按照每5✖️10^6个细胞加入1mL Trizol的比例
细胞样本采集时的注意事项
- 细胞必须裂解充分后再寄送,不要将冻干的细胞直接寄送
- 细胞样品胰酶消化要注意把握消化程度,胰酶会消化细胞膜上的膜蛋白,导致细胞破裂,破裂的细胞释放RNAse会导致RNA的降解
- 对于1-1000个细胞的微量样本,样本需要保存在专门的细胞裂解液中(公司寄送),标明细胞的数量(这与PCR实验循环数相关)
细菌样本采集(略)

真菌样本采集(略)

血液样品采集(略)
- 采血管用EDTA或柠檬酸钠



外泌体样本(略)

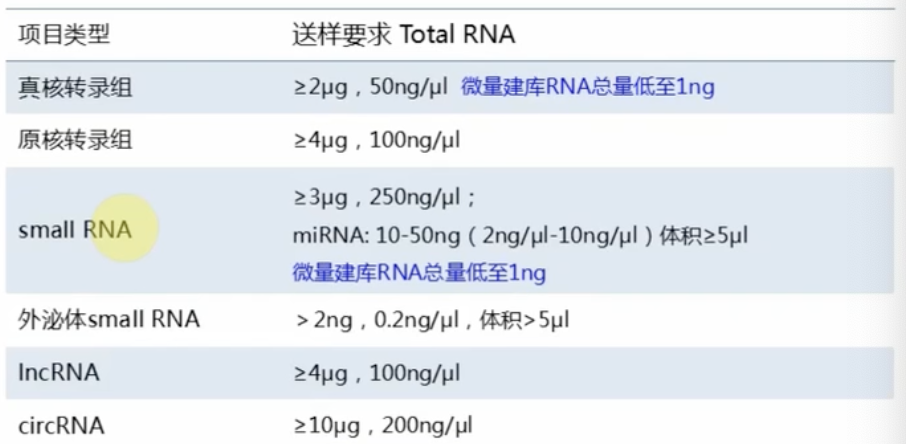
Total RNA样本
- Total RNA一般长期保存于-80°C冰箱,干冰寄送
- Total RNA中应当尽量避免多糖、蛋白、DNA等杂质的残留,送样时需要注明溶剂的成份
- Total RNA应当避免反复冻融,应对RNA样品小量分装
- RNA送样量
RNA降解的影响因素







