蛋白的翻译后修饰概述
- 蛋白翻译后修饰(post-translational modification,PTM),是指在mRNA被翻译成蛋 白之后,对蛋白上个别氨基酸残基进行共价修饰的过程。蛋白质翻译后修饰在生命体中具有十分重要的作用,它使蛋白质的结构更为复杂,功能更为完善,调节更加精细,作用更为专一。
- 细胞内许多蛋白质的功能,是通过动态的蛋白质翻译后修饰来调控的;细胞的许多生理功能,也是通过动态的蛋白质翻译后修饰来实现的。人类生命过程的复杂性不单是基因直接表达的结果,也是蛋白翻译后修饰的结果。通过翻译后修饰,使得一个基因并不只对应一个蛋白,更赋予了人类生命过程更多的复杂性。
- 目前已知的蛋白质共价修饰方式多达数百种,常见的翻译后修饰也有数十种之多,最常见的 翻译后修饰类型,包括磷酸化、泛素化、乙酰化\糖基化等。
泛素化修饰概述
- 在2004年,瑞典皇家科学院将当年的诺贝尔化学奖授予了两位以色列科学家阿龙·切哈诺沃和阿夫拉姆·赫什科以及一位美国科学家欧文·罗斯,以表彰他们发现了泛素调节的蛋白质降解机制。 在20世纪70年代至80年代之间,两位以色列的科学家阿龙·切哈诺沃和阿夫拉姆·赫什科都曾经在欧文·罗斯领衔的福克斯·蔡斯癌症研究中心做访问学者。在此期间,这三位科学家联名发表了一系列论文,揭示了泛素介导的蛋白质降解的机理,从而指明了蛋白质降解研究的方向。其中1979年在PNAS上发表的论文,被诺贝尔化学奖评选委员会认为具有“突破性成果”,并奠定了他们获得诺贝尔奖的基础。
- 真核细胞中含有至少3万个基因,而这些基因又可以通过选择性剪切等方式获得至少10万个蛋白。早期对蛋白质的研究过程中,很多工作都致力于阐述细胞怎样控制特定蛋白质的合成,而对其相反过程,也就是蛋白质的降解问题研究得相对较少。当时也发现有很多负责蛋白质降解的酶,虽然这些酶都具有降解蛋白的作用,但是这些酶在作用时,都不消耗能量。在已知的许多蛋白质降解酶中,一个典型的例子是胰岛素,它的作用是将小肠中的食物蛋白质转化为氨基酸;另一个典型的例子是细胞中的溶酶体,其作用是降解从细胞外吸收进来的蛋白质。无论是胰岛素还是溶酶体,它们在作用的过程中,最大的特点是都不消耗能量。
- 然而,早在上世纪的50年代就有实验显示,细胞内蛋白质的降解需要消耗能量。这一现象一直困惑着研究者:为什么细胞内的蛋白质降解需要能量,而细胞外蛋白质的降解却不需要能量呢?1977 年,Goldberg及其同事在这个领域迈出了第一步。他们从不成熟的红血球及网状细胞中获得了一种提取液,这种提取液在催化异常细胞降解时需要ATP的参与。应用这种提取物,阿龙·切哈诺沃和阿夫拉姆·赫什科以及欧·罗斯在70年代晚期和80年代早期进行了一系列具有划时代意义的研究,成功地揭示了细胞内蛋白质的降解是一个多步骤反应的过程:蛋白质先被泛素标记,然后被分解。通过这个需要消耗能量的过程,细胞以高度特异性的方式对不需要的蛋白质进行降解。也正是因为这期间,三位科学家的杰出工作成就,终于在2004年为他们共同赢得了诺贝尔奖的殊荣。
泛素-蛋白酶体(ubiquitin-proteasome system,UPS)的关键组分介绍
- 泛素化过程通常由泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)介导。在泛素-蛋白酶体系统中,含有多个关键的组分:泛素、泛素激活酶(E1)、泛素结合酶(E2)、 泛素蛋白连接酶(E3)、去泛素化酶(DUB)和蛋白酶体。
泛素
- 泛素是一个由76个氨基酸组成,分子量仅为8.5 kDa的小肽,序列高度保守,且普遍存在于真核细胞内。
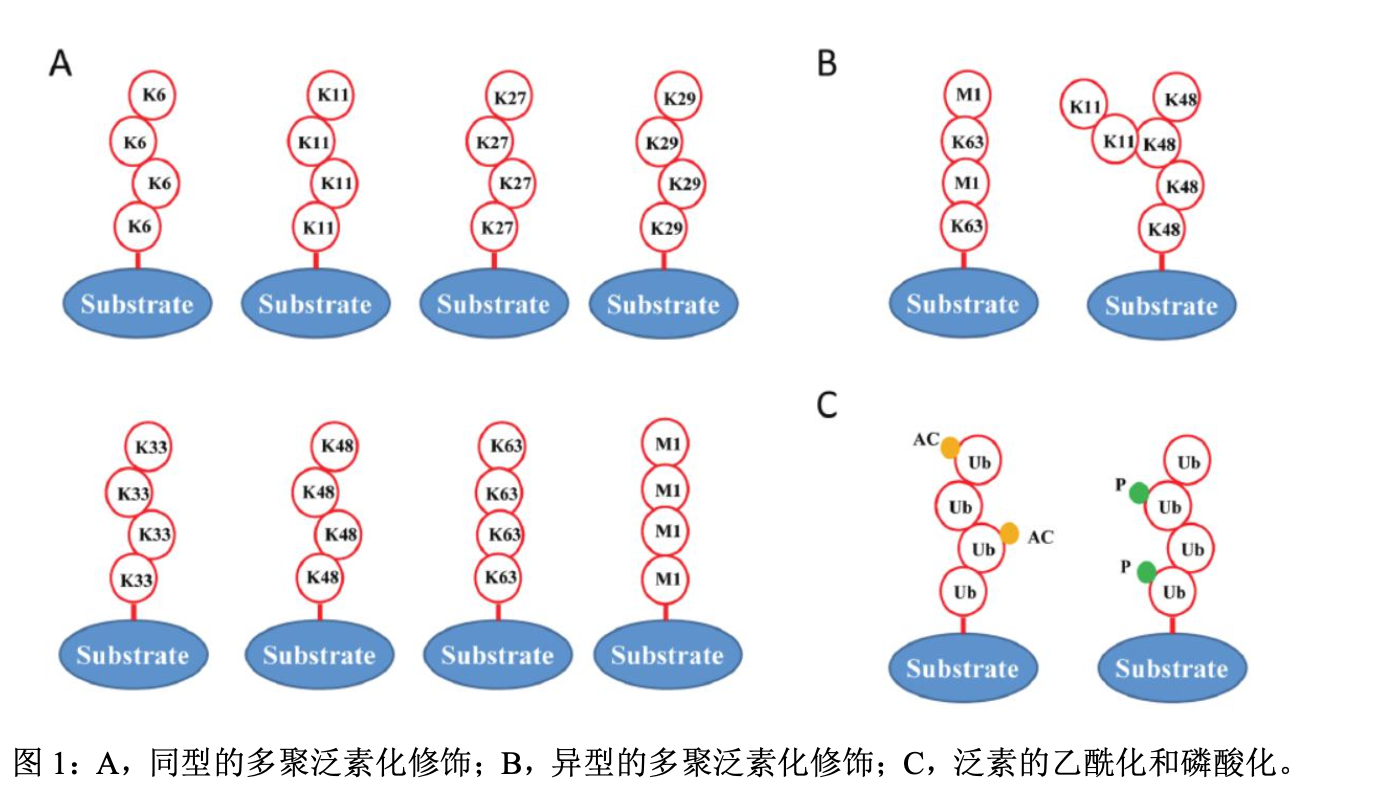
- 泛素分子内部含有7个赖氨酸残基,分别是K6、K11、K27、K29、K33、 K48、K63和1个N-末端甲硫氨酸残基(M1)。泛素分子可以通过自身的上述7个赖氨酸残基和1个N-末端甲硫氨酸残基和另一个泛素分子结合。
- 泛素与泛素之间的结合方式, 又可以分为同型的多聚泛素化修饰和异型的多聚泛素化修饰。
- 同型的多聚泛素化修饰:靶蛋白泛素链上的每一个泛素分子之间都通过同样一个氨基酸残基彼此相连
- 异型的多聚泛素化修饰:靶蛋白泛素链上的泛素分子之间存在多种类型的氨基酸残基之间的相互连接的状态。
- 蛋白质被泛素标记,本身已经是一种蛋白的翻译后修饰过程了,但是修饰蛋白的泛素,由于它自身也是一种长度很短的小肽,也能被翻译后修饰,例如磷酸化或者乙酰化修饰等等,这就使得泛素化过程变得更为复杂。
泛素连接酶E1
- 泛素激活酶E1是起始泛素化反应的酶,它的主要作用是通过消耗ATP的方式和泛素结合并激活泛素分子。具体过程是,E1在ATP的作用下,将泛素分子C-端甘氨酸的羧基连接到E1自身的活性半胱氨酸的巯基侧链上,形成高能的硫羟酸酯键。E1分子具有两个活性位点,能一次性调控和激活两个泛素分子。
- E1的序列在酵母、人和植物中高度保守。在人类当中有10 个泛素和类泛素偶联的E1酶或者E1复合物亚基,这些分子包括:UBA1-UBA7、NAE1、SAE1和ATG7。其中,只有 UBA1和UBA6是介导泛素化过程的,其他的分子分别介导类泛素化过程。特别请大家注意,ATG7是自噬相关的E1样酶,具体内容请大家参阅自噬相关的课程。
- E1具有三个活性结构域,分别是类似于细菌酰化酶结构的腺苷酰化结构域、围绕着具有催化活性半胱氨酸的结构域、以及识别泛素分子和E2的结构域。
泛素结合酶E2
- 泛素结合酶E2是泛素化反应的中间酶,可以结合E1和E3,通常也被称为泛素载运蛋白ubiquitin-carrier enzyme。E2酶家族经历过漫长而复杂的进化,高等级的真核生物在 E2酶的数量上大于低等级的真核生物。例如,人类已鉴定有35个具有活性的E2酶,但是酵母只鉴定有16个E2 酶。
- E2酶具有高度保守的结构域——泛素结合结构域ubiquitin-conjugating domain,缩写UBC。这个结构域通过结合在自身具有活性的半胱氨酸残基上的硫酯,结合由E1激活的泛素。泛素结合结构域UBC分子量是14-16kDa。不同物种当中,UBC 结构域的保守性较高。
- 泛素结合结构域UBC序列上,有象征活性的半胱氨酸位点,可以接受被E1激活的泛素分子,并与泛素之间形成硫酯键。这个反应发生之后, 带有激活泛素的E2随后与E3 相互结合;最后,E2将结合在自身的泛素分子转移到底物上,使底物蛋白完成泛素标记。
泛素连接酶E3
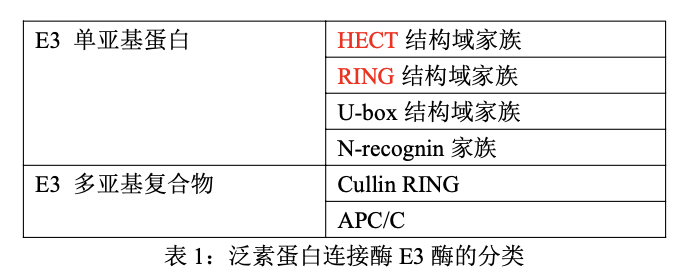
- 在泛素化过程中,泛素蛋白连接酶能够特异性地识别靶蛋白质。按照表现形式分类,E3可以分为单亚基蛋白质和多亚基复合物。目前已鉴定的E3单亚基蛋白质主要包括四个家族:HECT结构域家族、RING结构域家族、U-box结构域家族和N-recognin家族。E3 的多亚基复合物主要包括Cullin RING和APC/C两类
- 泛素蛋白连接酶E3是泛素化过程中最关键的酶。底物上通常具有可被特异性识别的模体, 这种模体也称为泛素化信号域。能特异性地识别和结合底物,指导泛素分子从E2转移到底物上,共价结合特定的赖氨酸残基。E2-E3复合物的晶体结构显示,泛素化中的许多反应物是围绕E3的活性位点展开的。因此,E3的功能体现了泛素化的特异性和高效性。
- 目前,HECT和RING已证明是E3分类中最大的两个家族。这两个家族的催化模型与序列或结构无关,但是它们运行的机制却是截然不同的。
- HECT家族的E3酶利用保守的半胱氨酸接受从E2转移来的泛素分子,形成E3和泛素之间的硫酯,然后再将泛素分子由这种共价结合的“E3-泛素”中间体转移到底物上。
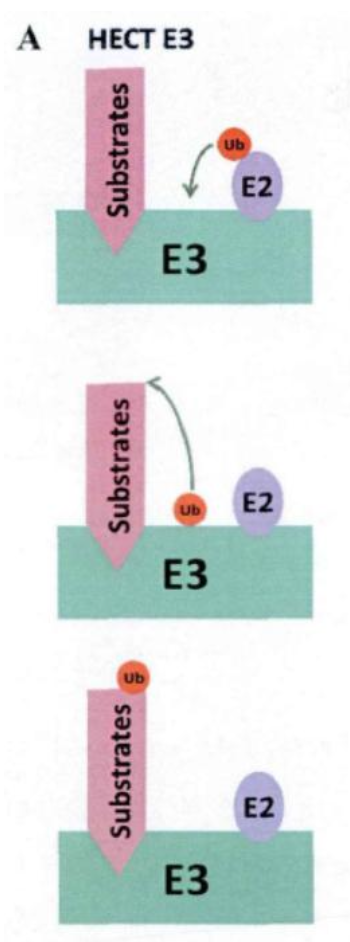
- 相反,RING家族的E3酶会将泛素分子直接从E2-泛素复合物中转移到底物上,在这个过程中,RING家族的E3酶不与泛素分子发生结合。
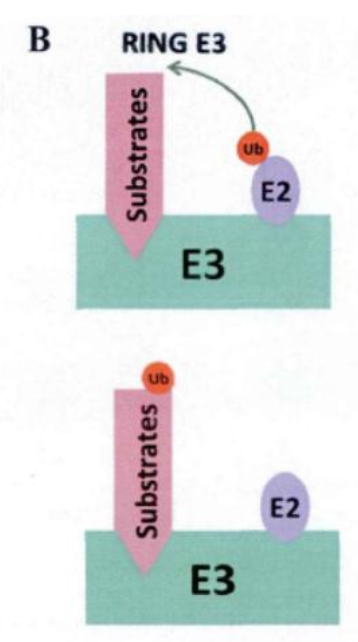
- 总结:HECT家族E3酶和RING家族的E3酶,在介导泛素转移到底物的过程中,HECT家族E3酶先和泛素形成一个E3-泛素的中间体,然后再将泛素转移到底物上,是一个两步骤的过程;而RING家族的E3酶直接介导泛素转移到底物上,是一个一步骤的过程。
去泛素化酶DUB
- 人类当中有100多个基因编码了DUB去泛素化酶基因,这些基因可以分为半胱氨酸蛋白酶cysteine proteases和金属蛋白酶metalloproteases两大类,详细的分类见下图

- 半胱氨酸蛋白酶类似木瓜蛋白酶,具有与木瓜蛋白酶相似的作用机制。它们利用二元或三元的氨基酸结构去催化泛素分子和底物之间的酰胺键的水解。这些能决定半胱氨酸蛋白酶催化活性的位点是半胱氨酸、组氨酸、天冬氨酸以及天冬酰胺。金属蛋白水解酶利用锌离子和组氨酸、天冬氨酸以及丝氨酸之间形成的特有结构,激活水分子,促进它们破坏泛素分子和底物之间形成的异肽键。
- 去泛素化酶DUB在去泛素化途径中具有重要的功能。它们能够移除蛋白质上的单聚泛素分子或多聚泛素链。当靶蛋白发生泛素化时,泛素分子通过异肽键结合到底物的赖氨酸残基上。 被泛素化的分子最终的命运是通过蛋白酶体被降解。而去泛素化酶DUBs能通过移除这些泛素化的修饰而起到一定的拮抗作用,进而改变蛋白质的命运。
蛋白酶体
- 蛋白酶体是一个多亚基蛋白酶复合体,分布于细胞质与细胞核内,是哺乳动物细胞中主要的中性蛋白水解酶,可占细胞蛋白质总量的1%。在真核生物进化中,蛋白酶体高度保守。
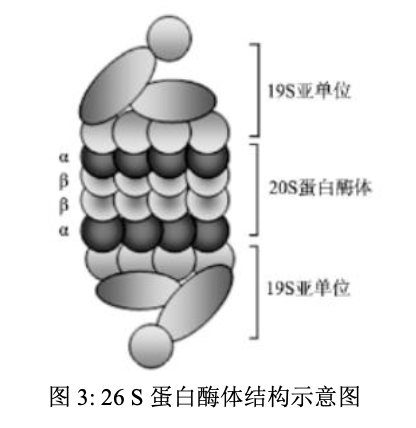
- 我们通常说的蛋白酶体指的是26S蛋白酶体形式。26S蛋白酶体由20S蛋白酶体和19S亚复合体构成。
- 每个19S亚复合体含有多个ATP酶活性位点和泛素结合位点,可以识别泛素化的靶蛋白,而且在靶蛋白进入20S蛋白酶体前,对靶蛋白进行去泛素化、同时打开靶蛋白的结构折叠。
- 真核细胞的20S蛋白酶体含有两个α环和两个β环,这些α环和β环共同组成一个圆筒状结构。无论是α环还是β环,都是由7个相同的亚基组成,也就是α环内含有从α1-α7的7个亚基;类似地,β环内也含有从β1-β7的7个亚基。在20S蛋白酶体内,α环位于外层,主要用于底物的识别;β环位于内层,主要负责催化底物的降解。3种发挥催化作用的亚基位于β环分子的内表面,并表现出半胱氨酸蛋白酶样活性、胰蛋白酶样活性和糜蛋白酶样活性,分别酶解羧基端酸性、碱性、疏水性或芳香性氨基酸残基。
泛素化过程
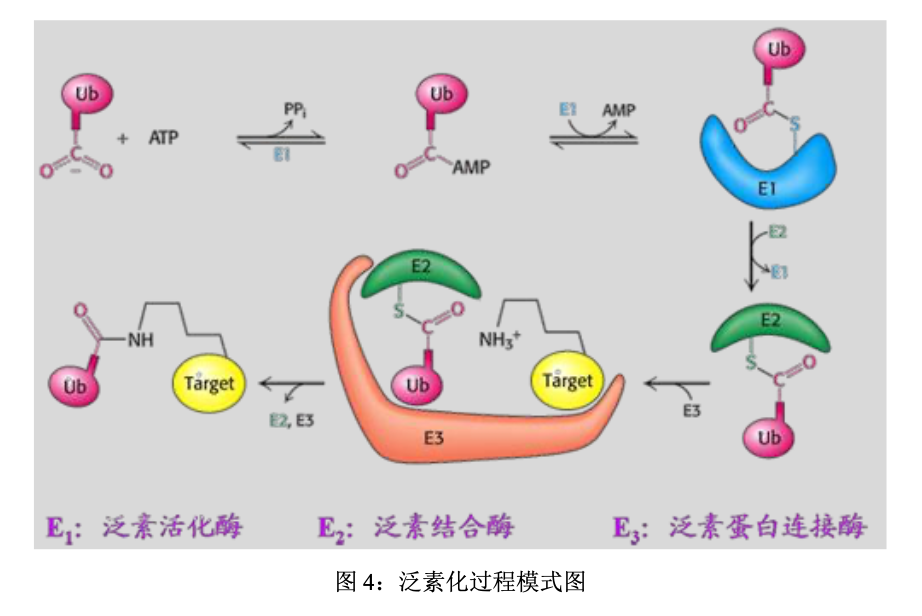
- 第一步:E1酶激活泛素分子,此过程需要消耗以ATP形式存在的能量,同时形成E1-泛素的中间产物
- 第二步:泛素分子从E1被转移到E2酶上,形成E2-泛素的中间产物
- 第三步:E3酶先识别待降解的靶蛋白,然后E3酶再识别 E2-泛素中间产物,从而形成一个包含E2-泛素中间产物,E3酶和靶蛋白的复合物。同时,在这个复合物内,E3介导泛素标记物从E2酶转移到靶蛋白上
- 第四步:E2酶和E3酶从上述的复合物中释放,从而形成被泛素标记的靶蛋白
- 第五步:重复上述过程,直到蛋白质上连接的多个泛素形成一条泛素链
- 第六步:被泛素化的靶蛋白,会被26S蛋白酶体识别和降解。被泛素化的靶蛋白先被19S亚复合体识别。随后,19S亚复合体切除靶蛋白上的泛素链。最后20S蛋白酶体将靶蛋白切割成小片段。
泛素-蛋白酶体在生理过程中的重要作用
阻止植物的自授粉
- 多数植物都是双性,即雌雄同株的。如果雌雄同株的植物中出现自授粉现象,其基因多样性就会逐渐减弱。如果这种情况持续出现,就会导致该物种的灭绝。植物避免这种情况出现的 措施就是利用泛素介导的蛋白质降解来排斥自身产生的花粉。虽然这一过程的具体机理尚未被阐明,但是目前已经知道的是,在这个过程中有E3酶的参与;并且实验已经证实,当授粉过程中,加入蛋白酶体抑制剂,阻断泛素-蛋白酶体系统功能时,植物对自身花粉的排斥作用,会受到显著的影响。
泛素化修饰与细胞周期调控
- 对所有真核细胞而言,将周期相关蛋白标记上泛素,这个过程对于正确的细胞分裂至关重要。在超过600种E3泛素连接酶中,SCF(skp1–cullin1–F-box)与APC/C (anaphase promoting complex/cyclosome)E3酶对细胞周期调控最为重要。SCF和APC/C这两种E3酶复合物具有相似的分子结构,SCF中含有cullin作为RING结构域;在APC/C中,含有cullin相关脚手架蛋白作为RING结构域,SCF和APC/C通过各自的RING结构域,结合E2-泛素中间产物以及底物,从而催化泛素化反应。
- SCF与APC/C可以通过促进细胞周期相关蛋白的降解,从而完成不可逆的细胞周期转换。这些细胞周期相关蛋白包括cyclins、aurora,CDC25磷酸酶以及CKI等。与SCF与APC/C通过降解细胞周期相关蛋白相反,细胞可通过一系列调控机制,反过来影响SCF与APC/C,从而调控细胞周期的进程。
- 尽管SCF与APC/C的结构与功能高度相似,它们的调控方式却迥然不同。对于SCF而言,底物通常都需要被磷酸化修饰之后,才能被SCF识别;如果底物的磷酸化位点发生突变,就会导致底物不被SCF识别和降解,会在细胞内产生不受限制的细胞分裂。而大部分APC/C的底物,并不需要磷酸化就可以被APC/C识别并降解。反而是细胞通过磷酸化或其他机制调控APC/C本身的活性而调节细胞周期转换。因此,SCF,APC/C和细胞之间,形成了一种双向调控的关系:E3酶复合物SCF,APC/C等调控细胞周期的转化,但是与此同时,细胞也可以通过磷酸化等方式,反过来调控了SCF和APC/C的活性。例如,细胞使 SCF的底物发生去磷酸化反应,从而抑制SCF对于底物的识别和降解;或者细胞通过磷酸化APC/C复合物,从而抑制它的功能。这样一种细胞和E3酶之间的双向调控关系,保证了细胞内的细胞周期可以正常持续地进展。
泛素化修饰与受体内化
- 配体诱导的跨膜受体的激活,可启动一系列胞内信号通路而调控关键的细胞生物学过程,如细胞增殖、分化、迁移与存活等。因此受体通路的时空调控对细胞正确的生物学功能极为重要。其中一类调控机制便是对受体的泛素化修饰,通过促进受体内化并靶向溶酶体降解,从而确保受体通路的及时终止。
- 由于受体酪氨酸激酶(receptor tyrosine kinases,RTKs)在细胞生物学功能中的核心作用,对RTK的泛素化修饰研究也最为充分,尤其对于EGFR,早已成为泛素化研究领域的热点分子。有研究发现,超过50%表皮生长因子受体EGFR连接的泛素是以K63泛素链形式存在的,而且这种K63泛素链修饰显著促进了受体的内化和靶向溶酶体的降解过程。研究发现,当配体EGF诱导EGFR激活后,EGFR很快发生泛素化,起作用的E3酶主要是Cb1。Cb1可以被招募到激活的EGFR胞内段的磷酸酪氨酸残基部位,促进激活的EGFR发生泛素化。EGFR的泛素化修饰过程受到配体浓度的影响。当配体EGF处于低浓度时,EGFR的泛素化程度很低,难以被检测到;当配体EGF处于高浓度时,大量EGFR处于泛素化状态。尽管泛素化对EGFR的具体调控机制与作用还不完全清楚,但是实验数据表明,泛素化可以影响EGFR的内化程度、内化路径,从而调控EGFR的命运,最终改变整条EGFR信号通路。
泛素化修饰与细胞凋亡
- p53是凋亡途径中一个非常重要的抑癌基因。p53强大的肿瘤抑制功能,主要是因为p53分子在各种细胞应激条件下,可以作为转录因子,调控下游一系列负责细胞周期阻滞和凋亡的靶基因的表达。MDM2是p53非常重要的一个负调控因子。MDM2本身也是一个E3酶,通过泛素化p53,促进p53的降解。因此,在正常细胞内,细胞通过MDM2介导的泛素化过程持续降解p53,使得p53分子在正常细胞内持续保持较低的表达水平。
- 另一类分子家族凋亡抑制因子IAP(inhibitor of apoptosis)家族成员,也是E3酶。IAP家族成员可以影响Caspase的稳定性。通过对凋亡不同途径和不同底物的泛素化修饰,IAP不仅可抑制线粒体途径的凋亡通路,还可抑制外源性凋亡通路。家族成员XIAP(X chromosome-linked IAP)可以直接与caspase3、7、9相互作用而抑制它们的酶活性,并且介导泛素化,促进这些caspase酶的降解。在TNF receptor1(TNFR1)信号通路中,IAP1和C-IAP2也可以通过泛素化的方式负向调控caspase8的活性。
补充:类泛素化过程
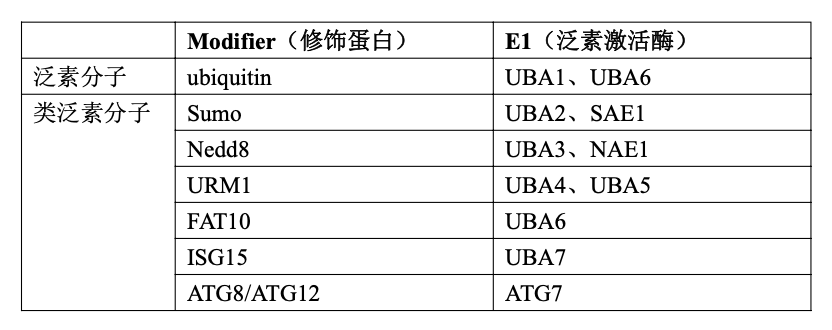
- 自从科学家在细胞内发现了泛素化过程之后,经过深入研究后发现,细胞内除了泛素化过程,还有很多的反应过程和泛素化过程非常地相似,这一类过程就被称为类泛素化过程。对于泛素化过程而言,就是泛素通过E1/E2/E3被修饰到靶蛋白上。对于类泛素化过程,其他的小肽分子(泛素除外),同样通过类似的E1/E2/E3被修饰到靶蛋白上。
- 具体来讲,可以把sumo(Small Ubiquitin-like Modifier,同样是一段小肽)修饰到靶蛋白的过程, 被称为sumoylation。可以把NEDD8修饰到靶蛋白的过程,被称为neddylation。上述过程中提到的泛素ubiquitin、sumo和NEDD8被统称为修饰蛋白modifier,其中sumo、 NEDD8又被称为类泛素分子。E1和修饰蛋白之间的关系,请参见下表。
泛素化对于信号通路的调控
泛素-蛋白酶体调控Akt-mTOR信号通路
- Akt-mTOR信号通路是细胞感受外界能量变化和刺激的重要信号通路之一,与肿瘤发生、代谢及衰老等现象都密切相关。其中最重要的一个核心分子就是蛋白激酶Akt,它的活性异常是肿瘤发生的重要机制之一。Akt是一种丝氨酸/苏氨酸蛋白激酶,在细胞内调控许多生物学功能,例如细胞凋亡和细胞增殖等等。
- 研究表明Akt的激活是在细胞质膜上。有研究发现,泛素化修饰介导了Akt定位到细胞质膜上的过程。有两个E3泛素蛋白连接酶TRAF6和SKP2,可以通过相似的泛素化修饰的方式调控Akt在细胞质膜上的定位。具体的机制是E3酶TRAF6和SKP2能够促进Akt的第8和14位的赖氨酸发生K63型的泛素化。发生K63型泛素化修饰的Akt能够促使Akt定位到细胞质膜上,并使得Akt被相应的激酶激活。这一结果充分证明了泛素化对于Akt活性以及肿瘤发生过程的重要性。
- Akt除了能够在第8和14位赖氨酸发生K63型泛素化之外,还有研究发现CHIP、Nedd4、TTC3也能够通过K48型的泛素化降解途径降解Akt,从而关闭Akt-mTOR信号通路。与Akt的泛素化过程相反,去泛素化酶CYLD能够特异性地去除Akt的K63型的泛素化标记,从而保持细胞内Akt泛素化与去泛素化过程之间的动态平衡。
泛素化过程调控Hippo-YAP信号通路
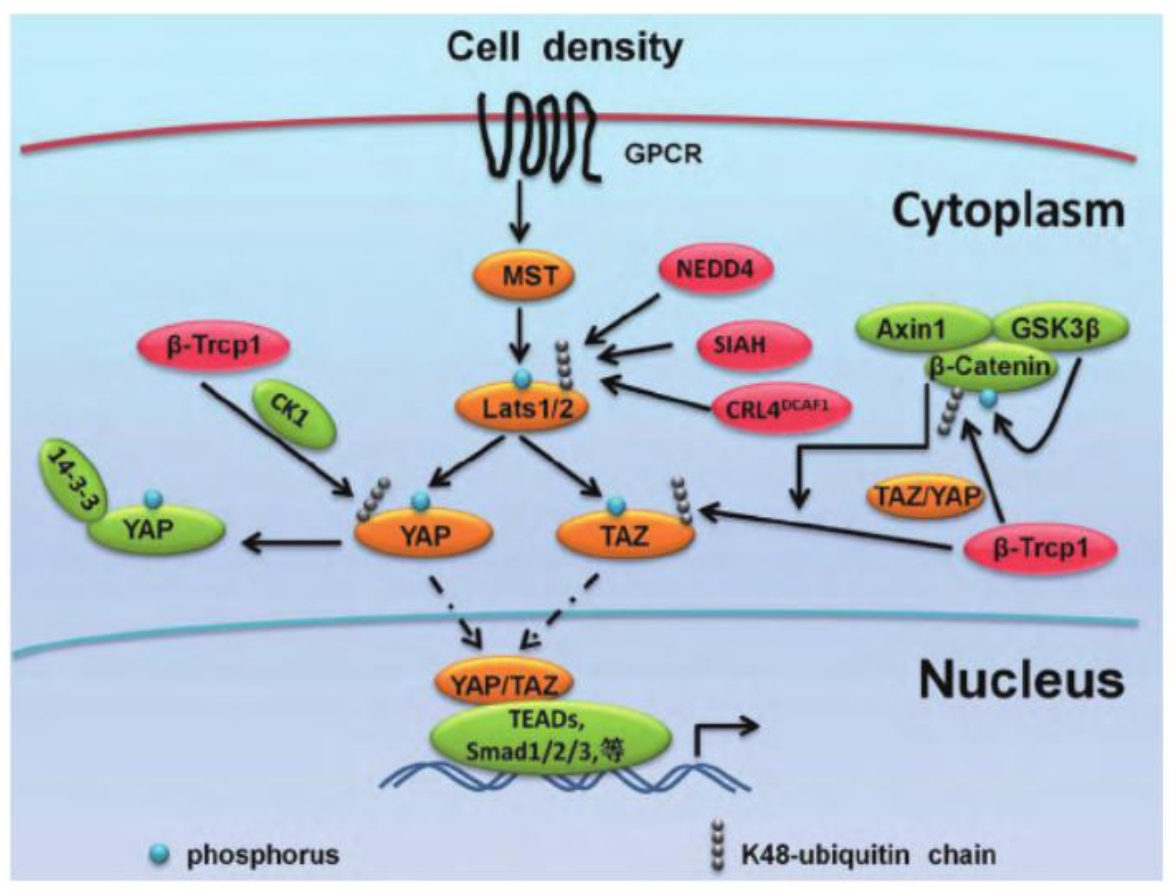
- Hippo-YAP信号通路与组织器官生长及肿瘤的发生密切相关。YAP是Hippo信号通路下游的效应分子。YAP基因定位于11号染色体的长臂上,除了外周血白细胞之外,YAP mRNA广泛表达于人体各组织中。YAP是一种转录共激活因子,它并不能直接与DNA结合,而是通过与转录因子TEAD相互作用,启动下游基因的转录,从而调控细胞增殖和组织生长。
- 当组织在发育过程中持续发生细胞扩增时,YAP可以入核并且和转录因子TEAD相互结合,调控下游基因的转录表达,促进细胞增殖和组织生长。但是器官或组织不会无限制地增长,必要时机体必须限制细胞的过度增殖,这时Hippo通路就被激活。Hippo通路的激活过程是,细胞表面配体Dchs1/2(Dachsous 1/2,果蝇中为Ds)和相邻细胞表面受体Fat4(FAT tumor suppressor homolog 4,果蝇中为Fat)结合,激活激酶MST1和MST2(Mammalian sterile 20-like kinase 1/2,果蝇中为Hpo)。其中激酶MST1和MST2在果蝇中的同源蛋白就是Hippo,因此整条信号通路也被称为Hippo信号通路。MST1/2激酶磷酸化并激活另一类激酶LATS1与LATS2(Large tumor suppressor 1/2,果蝇中为Wts)。LATS1/2激酶的主要靶蛋白是转录调控因子TAZ和YAP(Tafazzin/Yes-associated protein,果蝇中为Yki)。磷酸化的TAZ/YAP与14-3-3蛋白结合,使TAZ/YAP定位于细胞质中无法再进入细胞核,从而丧失作为转录辅助因子的功能。简而言之,Hippo通路通过磷酸化来负调控下游效应分子YAP的转录活性,以限制组织的过度生长,是维持细胞增殖和凋亡稳态的重要途径(图1)。
- 翻译后修饰在Hippo信号通路中起着非常重要的作用。目前已经报道,有多种泛素蛋白连接酶E3能够促进LATS1/2的泛素化。例如CRL4^DCAF1能够泛素化降解LATS1,从而抑制Hippo信号通路;另一个E3泛素蛋白连接酶SIAH2也能够泛素化降解LATS2。但是SIAH2的功能除了泛素化之外,还可能起到连接HIF1α信号通路和Hippo信号通路的作用。因为SIAH2同样也是HIF1α信号通路的重要调控因子。当细胞处于低氧环境时,SIAH2一方面能够通过泛素化途径降解PHD3/1,使得HIF1α积累,并激活HIF1α信号通路以应对低氧环境;另一方面,SIAH2泛素化降解LATS2,从而导致YAP不再被磷酸化,从而进入细胞核内。入核的YAP除了能够和TEAD相互结合激活Hippo信号通路,还能够抑制VHL和HIF1α的相互作用,从而促进了HIF1α信号通路。因此,低氧环境可以通过E3酶SIAH2,不仅能够泛素化调控Hippo信号通路,Hippo信号通路还能够反过来稳定HIF1α并调控HIF1α信号通路。
泛素化调控NF-κB信号通路
- NF-κB信号通路中重要的分子,详见三十六策 Lesson 6和之前的二十四型课程
- NF-κB
- i-κB(I-inhibitor,负调控NF-κB)
- iKK
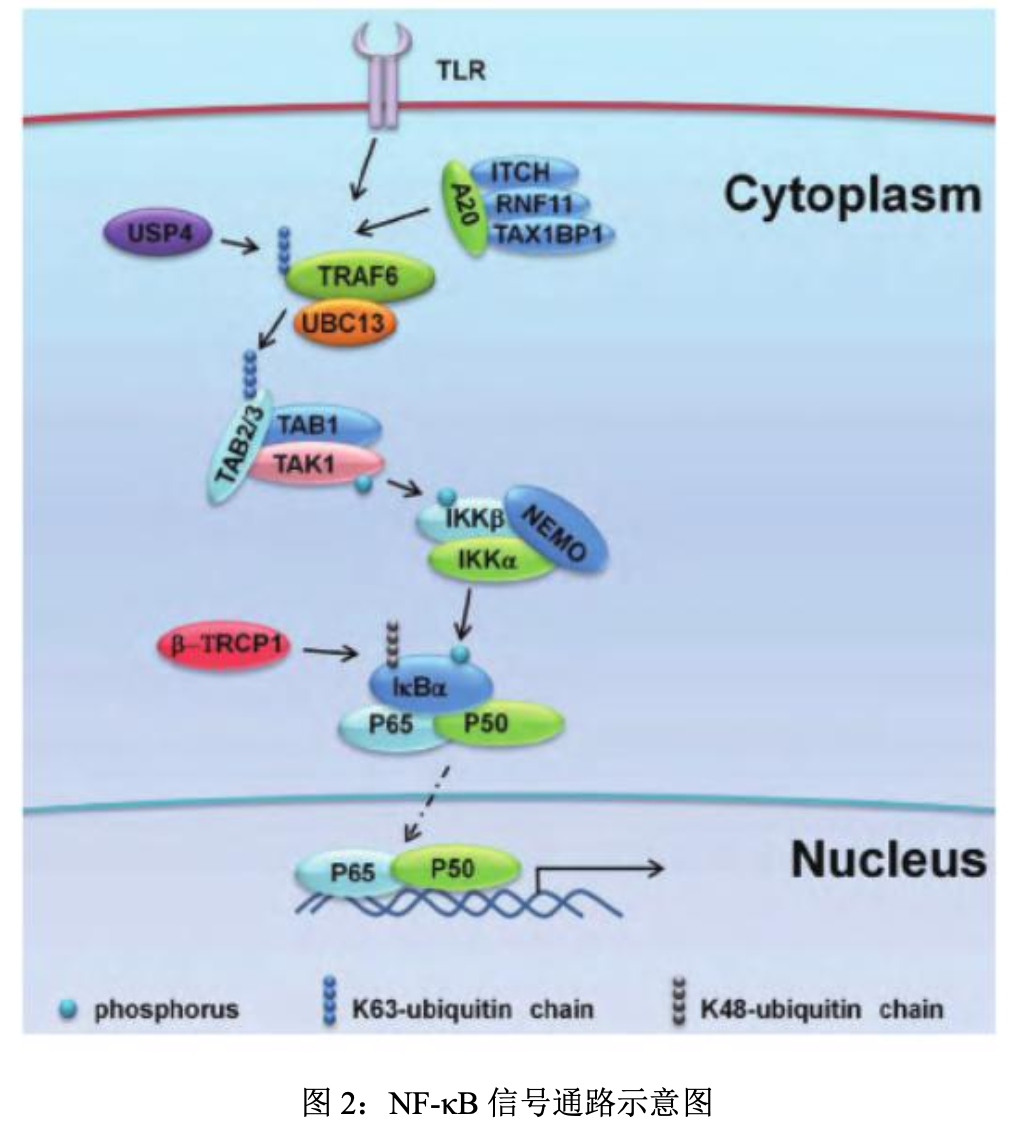
- 当NF-κB信号激活后,i-κB激酶(i-κB kinase,IKK)被激活,磷酸化i-κB,并且在E3泛素蛋白连接酶β-TRCP的作用下,使i-κB发生K48型的泛素化修饰,并且最终被细胞内的蛋白酶体所降解。在NF-κB信号通路激活过程中,泛素化修饰是i-κB降解和NF-κB信号激活所必需的。
- 进一步的研究证实,泛素化修饰与去泛素化修饰对免疫系统的调节起到了非常重要的作用, 比如在固有免疫反应的NF-κB信号通路中,TRAF6与A20是两个重要的E3泛素蛋白连接酶和去泛素化酶。研究发现,IKK本身也可以被TAK1复合物磷酸化修饰。TAK1也叫MAP3K7。E3酶TRAF6泛素化TAK1复合物,从而激活TAK1,再由TAK1顺次激活IKK并将NF-κB通路的信号传递下去。当然,NF-κB信号通路若是过度激活也是有害的,A20作为去泛素化酶,起到NF-κB信号通路中的负调控因子的作用,对避免信号通路的过度激活起着很重要的作用,A20可以和RNF11、ITCH和TAX1BP1形成复合物,去除TRAF6形成的K63型的泛素链,从而保持信号通路在泛素化和去泛素化之间的平衡,保证信号通路的可控。
泛素-蛋白酶体在病理过程中的重要作用
- 在介绍完泛素化所调控的信号通路之后,我们会发现受到泛素化调控的信号通路,无论是AKT-mTOR通路,Hippo-YAP通路或者是NF-κB通路,都是介导细胞正常增殖、分化,免疫等过程中的非常重要的信号通路。一旦泛素化过程发生错误都会导致上述这些信号通路发生异常,很容易导致疾病的发生。
泛素化异常与恶性肿瘤
- 癌基因蛋白的稳定及抑癌基因蛋白的不稳定都可以引发肿瘤,而泛素化过程及去泛素化过程和癌基因蛋白的稳定及抑癌基因蛋白的不稳定有着密切的相关性。比如,某些癌基因蛋白, 若不能及时通过泛素-蛋白酶体系统降解,清除出细胞,就会诱导细胞恶变;而抑癌基因蛋白,通过去泛素化作用,得以稳定,从而抑制肿瘤的发生
泛素-蛋白酶体系统调控细胞周期蛋白的稳定性
- 在细胞进行正常分裂时,细胞周期的不同阶段依赖不同的特异性周期蛋白。细胞内对于不再需要的周期蛋白,会通过泛素化的方式进行降解关闭相应的信号。如果细胞内的泛素-蛋白酶体系统发生功能缺失或者紊乱,会导致细胞周期相关蛋白表达的紊乱,从而产生细胞周期的失控,最终导致细胞癌变。
泛素-蛋白酶体系统调控肿瘤抑制因子的表达
- p53肿瘤抑制因子在正常细胞中低水平表达。即使由于某些原因(例如细胞周期紊乱等)表现出暂时性的p53表达升高的现象,但是高表达的p53也总是能够很快被降解。
- 在某些肿瘤中,泛素-蛋白酶体系统表现出过度激活的状态,导致即便细胞内发生了异常的情况,p53蛋白依然被过度泛素化降解,从而导致p53表达量过低,无法起到抑癌基因的作用。
泛素化过程参与调控多条关键的信号通路
- 一旦泛素化过程发生错误和紊乱,都会导致上述这些信号通路发生异常,很容易导致细胞发生癌变。
泛素化异常与神经退行性疾病
- 异常蛋白的积聚和沉积是神经退行性疾病的共同病理机制。许多研究表明,泛素-蛋白酶体系统的异常表达可能是导致神经退行性疾病的主要原因。神经退行性疾病中的泛素-蛋白酶体系统的损伤假说有一系列细胞学和遗传学数据支持。例如,这些疾病都存在着不同环节和不同程度的泛素-蛋白酶体系统的损伤,包括泛素化过程、去泛素化过程以及底物传递过程等。因此,激活蛋白酶体、增强其对错误折叠蛋白质的降解能力,已经成为治疗神经退行性疾病的一种可能的方法。
阿尔茨海默病
- 阿尔茨海默症的发病与合成缺陷蛋白、蛋白被错误转运至细胞膜以及氧化性损伤有关,并伴有β-淀粉样蛋白(amyloid beta,Aβ蛋白) 的累积和tau蛋白的过度磷酸化等现象。
- 研究发现,在阿尔茨海默病中,无论是泛素-蛋白酶体系统自身出现问题,或是因为其他因素的干扰导致泛素-蛋白酶体系统的功能被抑制,都会导致tau蛋白的过度磷酸化和Aβ(β-淀粉样蛋白)的降解发生障碍。β-淀粉样蛋白是由淀粉前体蛋白产生的毒性代谢产物,是阿尔茨海默病中转化成老年斑的主要物质,被认为是发生阿尔茨海默病的各种病理变化的起始因素之一。泛素-蛋白酶体系统出现问题,使tau蛋白和β-淀粉样蛋白因无法及时清除而堆积,产生神经原纤维缠结和老年斑。缠结和斑块持续聚集又会抑制蛋白酶体的降解活性,如此反复循环不断地促进阿尔茨海默病的发生发展。
帕金森病
- 帕金森病的发病机制还不是很清楚,但是很多的研究证据表明,泛素-蛋白酶体系统的功能改变是帕金森病的重要发病因素。在散发性帕金森病中存在泛素-蛋白酶体系统的功能异常。通过基因定位分析,已经发现了多个和家族性帕金森病直接相关的基因和基因的突变,这些基因包括α-突触核蛋白基因(α-synuclein)、parkin基因(parkin基因本身就是一个编码E3泛素蛋白连接酶的基因)以及泛素羧基末端水解酶1基因(ubiquitin C-terminal hydrolase L1, UCH-L1)。这些基因和基因的突变都和泛素-蛋白酶体系统的功能异常密切相关。一旦这些基因出现功能紊乱,都会干扰泛素-蛋白酶体系统对于异常蛋白的正常降解过程。因此,泛素-蛋白酶体系统的功能异常,可能是不同家族性帕金森病发病的一个共同途径。
- 进一步的研究发现,在神经退行性疾病所造成的神经元死亡中,受损线粒体的累积具有核心的作用。在正常的神经元内,当细胞内的线粒体受损时,E3酶会被迅速活化,使神经元能够及时清除异常的线粒体,从而保持神经元的正常功能。但是在帕金森病的患者脑内,患者的神经元细胞内的E3连接酶处于显著的抑制状态,即便细胞内出现线粒体受损的现象,患者神经元内的E3酶依然不能被激活,从而无法清除受损的线粒体,最终导致神经退行性疾病的出现。因此,如果可以通过特定的处理,扰乱神经元内对于E3酶的抑制作用,E3连接酶就会被激活,进而快速识别受损的线粒体。通过这样的处理,有望在帕金森患者中延缓疾病的进程。
亨廷顿病
- 亨廷顿病的发病原因是4号染色体上亨廷顿基因(huntingtin, HTT)中,出现非常多的三联密码子CAG重复,一般CAG的重复数量都在35个重复或以上,结果导致聚谷氨酰胺片段扩大,从而产生突变型亨廷顿蛋白(mutant huntingtin,mHtt),这些突变的亨廷顿蛋白在神经元细胞内形成聚合体导致患者发病。鉴于突变型亨廷顿蛋白的累积,是其神经毒性的首要条件,因此清除突变型亨廷顿蛋白将有助于亨廷顿病的治疗。因此,神经元内,通过泛素-蛋白酶体系统,用于清除真核细胞内可溶性蛋白和短寿命蛋白的方式,以及通过自噬系统,用于清除长寿命蛋白、聚合蛋白和损伤细胞器的方式,这两种清除机制,对于神经元内错误折叠蛋白的清除,非常地重要。研究显示,被K48型和K63型泛素化修饰的突变型亨廷顿蛋白可以通过泛素-蛋白酶体系统被清除。
针对泛素-蛋白酶体而进行的药物开发
针对泛素蛋白连接酶E3的药物
- 由于泛素蛋白连接酶E3能够特异性识别待降解的底物,因此,研究人员相信,通过抑制E3的活性,从而控制相应底物的表达水平,这可能是一种能有效减少肿瘤治疗中不良反应的方法。所以,现在针对E3酶的药物研发是整个泛素-蛋白酶体系统中最为受到关注的领域。
- 在人类基因组的众多E3酶中,以MDM2(murine double minute 2)、E6AP(E6-associated protein)、SKP2(S-phase kinase associated protein 2)、Nedd4(neuronally expressed developmentally downregulated 4)和Fbw7(F-box and WD repeat domain-containing 7)为基础的研究最为常见。
- 肿瘤抑制因子p53在保持基因组的完整性、调控细胞周期、诱导细胞凋亡等胞内反应中发挥重要的作用。在细胞的正常状态下,p53始终处于较低的表达水平上;当细胞受到损伤时,p53作为一种转录因子被激活。机制研究发现,来自RING家族的E3酶MDM2能够与p53的转录活化结构域相互结合,抑制p53发挥转录调控的功能,促进p53蛋白的泛素化降解,阻断由p53介导的细胞周期阻滞现象或诱导细胞凋亡的功能。在此基础之上,第一个以E3酶MDM2为靶点的小分子抑制剂Nutlin首先被研发出来。Nutlin通过与p53结合,阻断MDM2与p53之间的结合作用,防止了p53被泛素化标记,从而提高细胞内p53的表达水平。但是Nutlin也存在应用上的局限性,只能诱导表达野生型p53的肿瘤细胞发生细胞周期停滞和细胞凋亡,对于细胞内含有突变型p53的肿瘤细胞往往效果不佳。遗憾的是,肿瘤细胞中含有突变型p53的肿瘤细胞才是大多数。因此,Nutlin的应用受限,这也促进了其他MDM2抑制剂,如RITA、MITA、HLI98等抑制剂的研发。
- E3泛素蛋白连接酶SKP2能识别很多的肿瘤抑制因子,并且介导这些因子的泛素化降解。SKP2识别的分子中,包括了p21、p27、钙粘蛋白(cadherin)、FOXO1等,这些分子很多都在细胞内发挥了抑癌基因的作用,因此SKP2介导抑癌基因的泛素化降解,诱导细胞发生癌变。研究发现,SKP2在乳腺癌、前列腺癌等多种癌细胞中过量表达,识别并促进了p27蛋白的泛素化降解。p27作为一种CKI,在调控细胞进入细胞周期方面至关重要。由于癌细胞内 SKP2介导的p27泛素化降解,导致癌细胞进入细胞周期的过程失控,获得无限增殖的潜能。于是,研究人员开发了一系列以SKP2为靶点的抑制剂化合物。其中一个抑制剂是CpdA,它可以通过阻止SKP2进入SCF(Skp1-Cul1-F-box)E3酶复合物,抑制SCF复合物的功能,引发肿瘤细胞的G1/S期细胞周期阻滞;还可以诱导肿瘤细胞发生凋亡从而控制癌细胞的增殖。另一种SKP2抑制剂是SMIP0004,它被证明能下调SKP2的表达水平,从而诱导前列腺癌细胞G1期细胞周期阻滞,抑制细胞的增殖和集落的生成。
针对蛋白酶体的药物
- 蛋白酶体活性的改变将影响正常的蛋白降解机制,并与多种疾病相关。有研究表明,肿瘤细胞的生存需要依赖蛋白酶体发挥活性,对蛋白酶体的抑制也更加地敏感。使用蛋白酶体抑制剂处理肿瘤细胞,将打破肿瘤细胞内部促凋亡蛋白和抗凋亡蛋白之间的平衡,诱发肿瘤细胞的周期阻滞和细胞凋亡现象,对促进肿瘤细胞的凋亡非常地有效。因此,蛋白酶体抑制剂被认为是克服化疗增敏、遏制肿瘤细胞扩散的有效靶点。
- 目前,第一代蛋白酶体抑制剂硼替佐米(Bortezomib)和第二代蛋白酶体抑制剂卡非佐米(Carfilzomib)在治疗多发性骨髓瘤和淋巴瘤等方面已有不错的疗效。硼替佐米是一种含硼酸盐的二肽化合物,能够可逆性结合20S蛋白酶体的亚基,抑制蛋白酶体催化底物降解的活性,是第一个由FDA批准的可以用于治疗多发性骨髓瘤和淋巴瘤的蛋白酶体抑制剂。但硼替佐米特异性差,对正常细胞也会造成一定程度的损伤;同时,在硼替佐米的临床应用时,发现一部分肿瘤患者仍对硼替佐米具有耐药性。为了克服硼替佐米的缺陷,研究人员研发并上市了第二代蛋白酶体抑制剂——卡非佐米。卡非佐米在结构上含有αβ环氧酮,能够与蛋白酶体的亚基结合形成不可逆的蛋白酶体抑制效果,使药效更为持久。虽然硼替佐米和卡非佐米这两代蛋白酶体抑制剂仍然存在着耐药性、口服性、剂量毒性方面的缺陷,但在临床上也确有较好的抗肿瘤效果,为未来以蛋白酶体抑制剂为方向的抗肿瘤药物的研究,打下了良好的基础。
针对去泛素化酶的药物
- 目前已有研究发现,去泛素化酶在多种癌细胞中存在过表达现象,水平明显高于正常细胞。例如,USP1在骨肉瘤细胞中水平明显增高,可去泛素化并固定DNA结合蛋白抑制剂ID1、ID2及ID3,从而保持骨肉瘤细胞中干细胞特性,促进其不断分裂增殖。而USP7在前列腺癌细胞中存在过表达现象,可通过抑制包括p53、FOXO4等肿瘤抑制因子的活性诱发肿瘤。因此,去泛素化酶抑制剂逐渐成为抗肿瘤药的新型研究方向。
- 目前,已发现多种去泛素化酶抑制剂对癌细胞具有抑制作用,可能具有潜在的抗肿瘤活性。例如,WP1130可抑制去泛素化酶USP9X、USP5、USP14及UCH37活性,下调抗凋亡蛋白MCL-1水平,并上调肿瘤抑制因子p53水平,提高细胞的抗肿瘤活性。2017年有研究表明,WP1130通过抑制雌激素受体阴性乳腺癌细胞中的USP9X,增加乳腺癌细胞对于顺铂的敏感性。USP7的特异性去泛素化酶抑制剂P5091可诱导对硼替佐米有耐药性的多发性骨髓瘤细胞的凋亡,并抑制肿瘤细胞的增殖。另有研究表明,USP14的特异性抑制剂可促进氧化蛋白的降解,增强癌细胞对氧化压力的抗性。选择性抑制USP14和UCHL5的去泛素酶抑制剂B-AP15不仅可以抑制对硼替佐米耐药的多发性骨髓瘤细胞的增长,同时还可抑制细胞周期蛋白Cdc25c、Cdc2和细胞周期素B1的表达,诱导癌细胞发生凋亡。
针对E1酶的药物
- 泛素激活酶E1是保证泛素化过程正常进行的首要前提,有研究表明,敲除E1后可导致白血病细胞和多发性骨髓瘤细胞的凋亡,从这一角度出发,E1有望成为治疗白血病及多发性骨髓瘤的新靶点。
- 自2002年第一个针对E1的小分子化合物panepophernanthrin被发现以来,更多的E1抑制剂被相继研发用于肿瘤治疗。例如,组蛋白脱乙酰化酶抑制剂拉格唑拉被证明能破坏泛素与E1腺苷酰结构域的结合,抑制癌细胞的增殖。具有细胞渗透性的E1抑制剂PYR-41可阻断受体相关因子TRAF6的泛素化,阻止i-κBα和p53的泛素化降解,且能够杀死表达p53的癌细胞,是一种有效的可用于治疗癌症的E1抑制剂。
针对E2酶的药物
- 有研究发现,泛素结合酶USE1在肺癌细胞中存在着过表达现象,而USE1的mRNA水平在癌细胞与正常细胞中相近,说明在肺癌细胞中USE1的表达后修饰出现了问题。由于肺癌细胞中USE1与E3泛素蛋白连接酶APC/C结合的D-box结构域发生错义突变,阻断了与APC/C复合体中的CDC20和CDH1链接蛋白的正常结合,导致USE1蛋白半衰期延长,胞内USE1蛋白水平升高,从而改变正常的细胞周期调控,促进了癌细胞的增殖和迁移。这一实验结果不仅为下一步的肿瘤治疗提供了研究基础,也表明USE1蛋白也可作为肺癌早期临床诊断的生物标志物。
- 泛素结合酶Ubc13能够与多个不同的泛素蛋白连接酶E3一起参与K63型的多聚泛素链的形成,在炎症和DNA损伤应答途径的信号转导过程中至关重要。2014年,有研究发现,Ubc13的表达是乳腺癌细胞代谢所必需的,而且它在前列腺、结肠、胰腺和淋巴瘤的肿瘤组织中也存在表达水平上调的现象。
- 目前,从海绵动物中提取出了环状肽LeucettamolA、化合物ManadosterolsA和ManadosterolsB,都被证实能通过阻断Ubc13与UEV1A的相互作用,从而抑制Ubc13-UEV1A复合体的形成,最终阻止K63型多聚泛素链的形成,抑制底物降解。另有两种Ubc13抑制剂NSC697923和BAY11-7082,被证实可以通过在Ubc13活性位点半胱氨酸残基上,经过迈克尔加成反应,形成共价加合物,分别抑制DNA损伤和NF-κB信号通路。
探究泛素化过程中常用的手段
生物信息学方法
Uniprot数据库
- 泛素化属于翻译后修饰的一个种类。目前关于蛋白的泛素化修饰,数据收录最为齐全的是Uniprot数据库。Uniprot 网站会根据发表的文献收录蛋白翻译后修饰相关的信息,以供网友们查询。具体的方法是,首先登陆Uniprot网站(网址:https://www.uniprot.org/) ,然后在检索栏中输入想要查询的蛋白名称,然后进行检索即可。例如,如果输入p53,找到人p53蛋白的信息网页,通过网页左侧的导航栏,直接前往“PTM/Processing”这部分。网页会显示所有文献中报道的,和p53相关的翻译后修饰的类型和发生修饰的位点以及相应的文献。对于p53而言,发生泛素化的位点有两处,291位和292位。如果想要深入了解相关信息,可以点击旁边的publication按钮。
- Uniprot数据库收集的都是已经有文献报道的蛋白翻译后修饰信息,但是Uniprot网站并不是一个专门只收集蛋白泛素化信息的数据库,因此Uniprot数据库在泛素化信息收集的专业性方面还存在诸多的不足。除了Uniprot数据库之外,还有一些专门收集蛋白泛素化信息的数据库。
UbiProt数据库
- UbiProt (http://ubiprot.org.ru/) 是一个收录泛素化修饰底物蛋白的数据库,由俄罗斯下哥罗德国立医学院创建。UbiProt数据库中每个数据条目描述了特定的泛素化底物蛋白信息,包括蛋白的性质、物种来源、泛素化修饰特征、参考文献及相关链接等。该数据库主要包含了一些大规模组学实验数据,其余的底物蛋白数据是从针对特定蛋白的泛素化修饰实验研究中得到的,数据库所有的条目都是通过人工手动的方式进行提取并注释的。UbiProt数据库以泛素化底物数据为主要收录对象,但是该数据库数据信息并不完善,比如很多条目的底物并不包含相应的E1、E2、E3信息,且数据较为陈旧,后续更新情况不理想。
E3Net数据库
- 由韩国科学技术院生物信息学实验室设计并开发(http://pnet.kaist.ac.kr/e3net/)。 该数据库在数据量方面较为庞大,且界面更为友好美观,从数据量及注释信息的丰富程度上来说,该数据库都是当前泛素化修饰相关蛋白数据库中最为出色的。E3Net数据库共收录了427个物种中2201个泛素化修饰E3及4896个底物蛋白信息,其中包含493个E3与1277个底物蛋白之间的1671个特异选择关系,该数据库的数据来源主要是文本挖掘方法挖掘MEDLINE摘要得到的结果、UniProt相关条目注释信息、公共泛素化数据库收录数据以及高通量实验数据。
- 该数据库收录的数据侧重于描述泛素化修饰E3与底物蛋白之间的对应关系,同时给出了相应的生物学功能分析,然而该数据库缺少E3相对应的E2信息,从整个泛素-蛋白酶体系统的角度看数据不够全面,注释信息的完整性也有待于进一步完善,在数据的更新及下载方面同样存在需要改进之处,不过该数据库是当前该领域最完全丰富的泛素化系统相关蛋白数据库,对于泛素化修饰领域的研究具有重要意义。
hUbiquitome数据库
- hUbiquitome(http://bioinfo.bjmu.edu.cn/hubi/) 是北京大学发布的一个数据库,旨在收录高可信度的实验验证的人类泛素化相关蛋白质,该数据库共收录了1个E1、12个E2、138个E3、279个底物蛋白以及17个去泛素化酶。该数据库规模较小,但可信度较高,由于收录的全部为实验验证的数据,且为人工手动录入,提高了数据库所收录数据的可靠性,但同时降低了数据量,倘若加入质量控制体系,多渠道收集数据并对数据进行打分,将对提高数据量有所帮助。此外,该数据库的条目注释信息较少,每个条目包含的相关信息不多,但该数据库包含了数据提交功能,更为友好的是提供了原始数据下载的功能,这是相对于其它泛素化相关蛋白质数据库显著的优点。
- 该数据库有一些值得关注的特点,作者在分析了UbiProt等网站在收录泛素化数据时存在的缺点之后,展开了针对人的泛素化修饰数据收录工作,收录数据的质量标准较高,人工整理,仅收录实验验证的泛素化修饰数据,按E1-E2-E3-底物的级联关系给出数据信息,对不同类别E3的底物进行了功能分析,虽然数量较少,但研究思路完整,数据的下载也较为方便。但另一方面,该数据库也存在一些值得改进的地方,比如数据规模较小,虽然包含修饰位点数据,但只有35个修饰位点数据,且网站缺少及时的维护更新。
实验探究
通过高通量手段进行泛素化蛋白质的检测
- 蛋白分子在发生泛素化之后,蛋白的分子量会因为泛素化标记而变大。如果蛋白分子被一个泛素标记,蛋白的分子量就变大了114Da,以此类推。通过质谱的方法,完全可以通过高通量的方式,检测出样品中蛋白被泛素化标记的情况。
- 通过质谱进行高通量检测的一般流程是:
- 第一步:提取蛋白样本。
- 第二步:胰酶酶解。胰酶酶解的目的是通过酶解反应将蛋白大分子消化为小分子量的肽段, 用于后续的质谱分析。
- 第三步:HPLC分级。 HPLC 分级有两个目的:降低每个组分中蛋白的复杂度,利于质谱鉴定;增加每个组分中每个蛋白的含量,同样利于质谱的鉴定。组分的多少和样品的复杂程度有关:如果分级数太少,没有达到降低样品复杂度的作用;如果分级数目太多,反而会降低每个组分中每个蛋白的含量,并且分级越多蛋白损失越大,因此分级太少和太多都不利于质谱鉴定。
- 第四步:利用可以结合并纯化泛素化底物的抗体,富集所有被泛素化标记的蛋白片段。
- 第五步:质谱分析。
- 第六步:数据处理和生物信息学分析。质谱分析后获得的结果需要和专业的蛋白泛素化数据库比对。常见的专业性蛋白泛素化数据库(例如hUbiquitome、E3Net、UbiProt等等),我们之前已经介绍过。
- 通常通过质谱进行样本泛素化高通量检测实验,都是由专业的公司来完成的。因为高通量实验对于质谱设备、样本处理、数据处理和分析、生物信息学分析等都有很高的要求。
对于E3泛素连接酶的鉴定
- 在人体内,E1泛素激活酶只有两个,分别是UBA1和UBA6。已经鉴定的具有E2泛素结合酶的分子在人体内只有35个。因此,无论是E1酶还是E2酶在介导底物泛素化过程中,都是采用“一对多”的方式进行的。只有E3泛素蛋白连接酶才具有底物识别的特异性。因此,在研究底物的泛素化过程时,找到并且验证E3酶是最为重要的工作。
- 要验证底物和E3泛素蛋白连接酶之间的关系,至少需要证明两个方面:E3酶和底物之间能够相互结合以及E3酶能介导底物的泛素化。
- 要证明E3酶和底物之间存在相互作用,可以采用Co-IP或者酵母双杂交的方法,因为E3酶是蛋白,底物也是蛋白,因此本质上,证明E3酶和底物之间有相互作用就是证明蛋白-蛋白之间有相互作用。
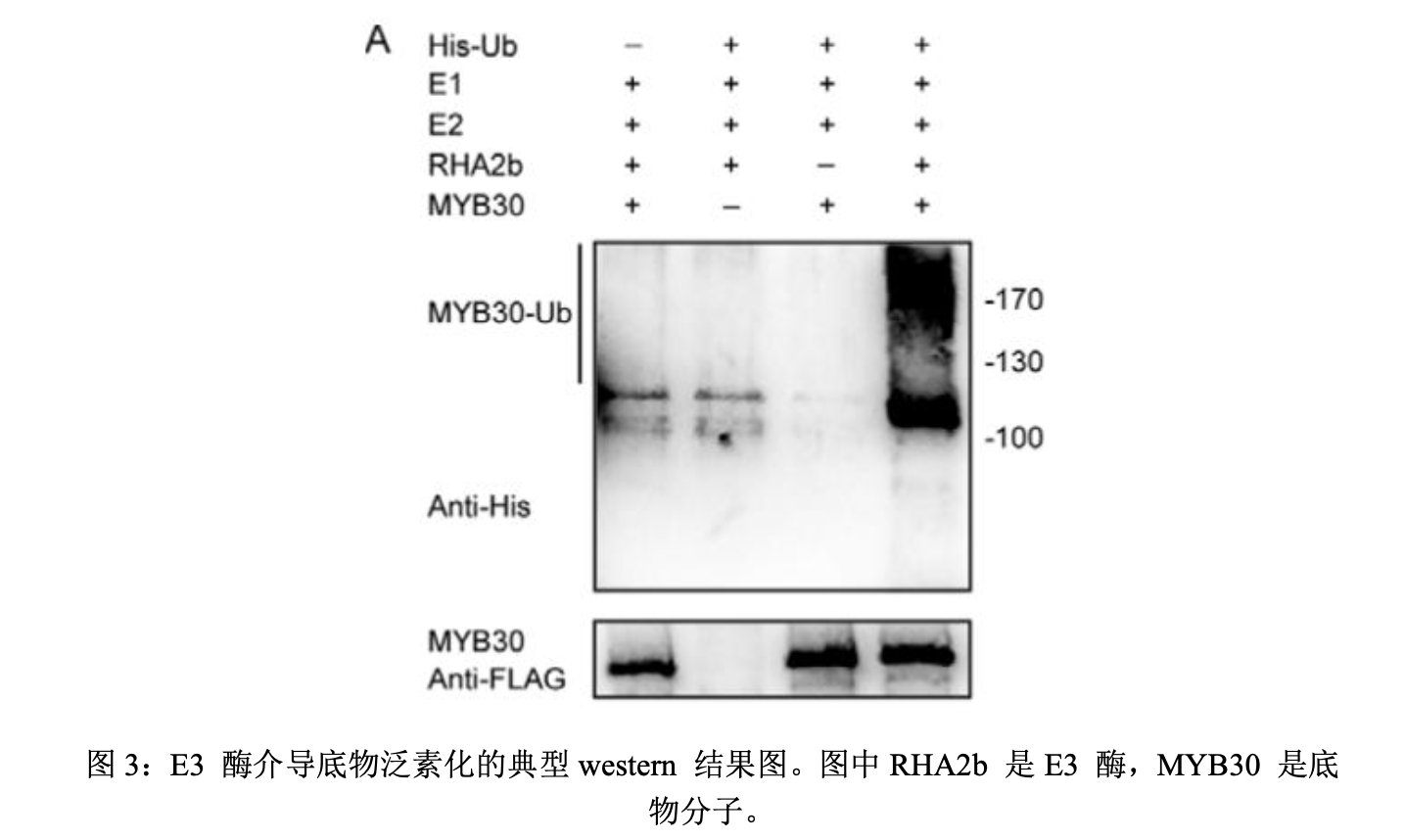
- 除了证实E3酶和底物之间的相互结合关系之外,还需要证明E3酶能介导底物的泛素化。这通常可以采用体外泛素化实验(In vitro ubiquitination assay)。在这个体外的泛素化实验中,需要在体外的系统中加入E1酶、E2酶、E3酶、底物和标签标记的泛素分子(常见的标签是Myc tag和His tag),随后上述这些组分混合并进行孵育。接着,通过SDS-PAGE分离蛋白。最后,通过标签蛋白的抗体(myc抗体或者His抗体),检测被泛素化标记的底物分子。由于底物可以被单个泛素标记,也可以被多个泛素分子标记,而且底物上的泛素链长度有长有短,并不均一。因此通过标签抗体检测到的底物分子,往往呈现出一片smear的形态。