自噬概述
- 细胞自噬autophagy,又被称为Ⅱ型细胞程序性死亡,是指细胞在外界环境的影响下,细胞利用溶酶体,降解自身受损、变性或衰老的大分子物质,以及细胞器的自我消化过程。
- 自噬是细胞的一种自我保护机制,广泛存在于真核细胞内,在调节细胞生存和死亡的过程中,都起到了非常重要的作用
- 自噬虽然被认为是一种细胞自我保护的机制,但如果自噬相关基因的过度上调,同样可以引起细胞的死亡,也就是说对自噬的理解不能太过教条。
- 研究表明,当细胞处于饥饿、内质网应激、缺氧以及辐射等状态下,都可以诱导细胞发生自噬现象
- 细胞发生自噬后,在自噬相关基因的调解下,细胞通过单层或双层膜,包裹待降解的细胞质或细胞器块,形成囊泡状的自噬体autophagosome
- 自噬体进而和溶酶体lysosome发生融合,最终形成自噬溶酶体autolysosome,由溶酶体内的一系列酶,降解自噬溶酶体内包裹的一系列内容物,实现细胞对自身代谢和能量的更新
- 研究表明,自噬功能紊乱会导致肿瘤、糖尿病、神经退行性疾病以及免疫失调等重大疾病的发生
自噬的分类
- 根据细胞内物质运输到溶酶体的方式和生理功能的差异,哺乳动物的细胞自噬可以分为以下三类
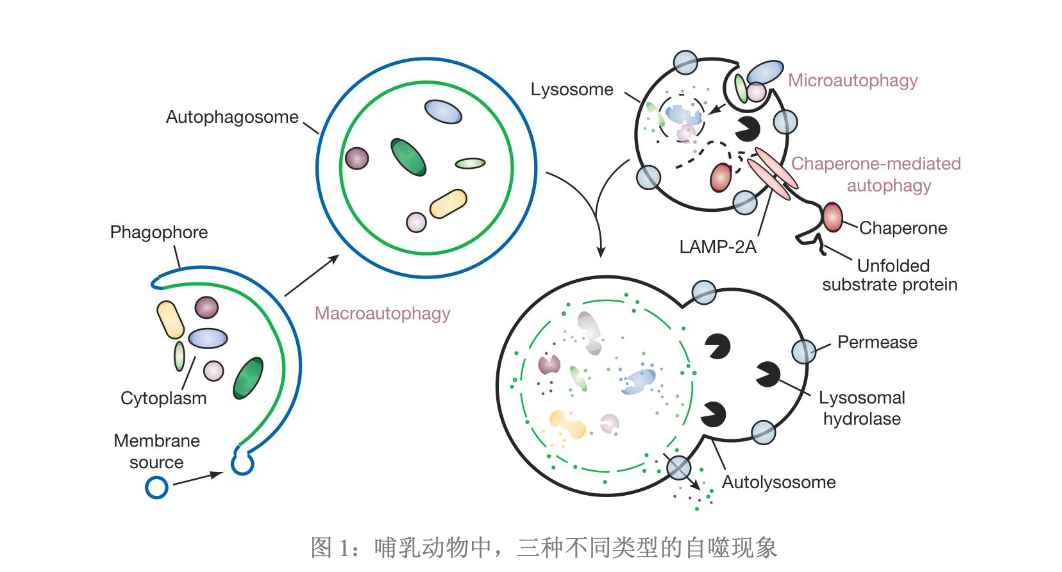
大自噬/宏自噬Macroautophagy
- 是通常意义上所说的自噬
- 在大自噬的过程中,细胞质中的可溶性大分子物质以及变性的细胞器,被内质网或线粒体来源的单层或双层膜包裹,形成自噬体,接着自噬体外膜和溶酶体膜融合,进一步形成自噬溶酶体
- 自噬体内的待降解物被一系列水解酶降解,最终完成整个的自噬过程
小自噬/微自噬Microautophagy
- 与大自噬有明显不同,是溶酶体膜自身发生内陷,包裹和吞噬细胞内待降解的底物,并在溶酶体内发生降解
- 小自噬和大自噬的区别:小自噬过程中细胞质成分会直接被溶酶体包裹,没有形成自噬体的过程
- 待降解的底物都是可溶性的蛋白质分子
- 分子伴侣蛋白识别含有特殊氨基酸序列的底物蛋白质分子,并与之结合,然后经过溶酶体膜上的受体LAMP2A转运到溶酶体内,底物蛋白质分子最后在溶酶体内被降解
- 分子伴侣介导的自噬和前面两种不同,在介导蛋白的降解时具有一定的选择性,而前面两种没有明显的选择性
细胞自噬发生的过程
- 细胞自噬是一个连续的细胞学行为,人为划分成三个阶段
双层分隔膜形成阶段/启动阶段
- 在缺氧、饥饿等条件的刺激下,在细胞质中,大量由内质网、线粒体等膜结构形成德维尔双层膜杯状双层膜游离在被降解物的周围,形成自噬前体
自噬体形成阶段
- 随着分隔膜的逐渐延伸,待降解的物质完全闭合在具有双层膜的自噬体内部
自噬溶酶体的形成与裂解阶段
- 自噬体形成后,经细胞骨架-微管系统运输到溶酶体内,自噬体与溶酶体发生融合,形成自噬溶酶体,并降解其内包含的细胞质或细胞器成分
- 降解产物在细胞内循环再利用
细胞凋亡与细胞自噬
- 细胞凋亡也被称之为Ⅰ型细胞程序性死亡,细胞自噬被称为Ⅱ型细胞程序性死亡
- 凋亡和自噬是两种具有显著区别的细胞死亡形式,两者在形态、生化指标以及调控细胞死亡的过程上,都存在很大的差异。但是,两者不是相互独立的过程,在某些情况下,细胞凋亡和细胞自噬的功能可以相互影响,相互制约,两者的相互作用可分为三种类型,而且每种类型都对应着相应的细胞类型,刺激和环境
- 两者之间相互转化的机制尚不明确,这已经是研究的热点研究,期待为肿瘤的防治提出贡献
情形1:细胞自噬和细胞凋亡相互协同
- 两种效应之间,可以一种效应影响另外一种,自噬也可以作为凋亡的上游调节因子,直接调控细胞凋亡,从而影响细胞的死亡
情形2:细胞自噬促进细胞存活,拮抗细胞凋亡
- 细胞自噬可以通过去除因氧化应激受损的细胞器,或者降解变性的大分子物质,为饥饿的细胞提供生存必须的营养和能量,或者通过降解未折叠的蛋白,减轻内质网压力,抑制内质网应激
- 自噬的这些功能会抑制促凋亡信号的产生,从而起到拮抗细胞凋亡的作用
情形3:细胞自噬不直接导致细胞死亡,但参与细胞凋亡的过程
自噬的分子机制和特征
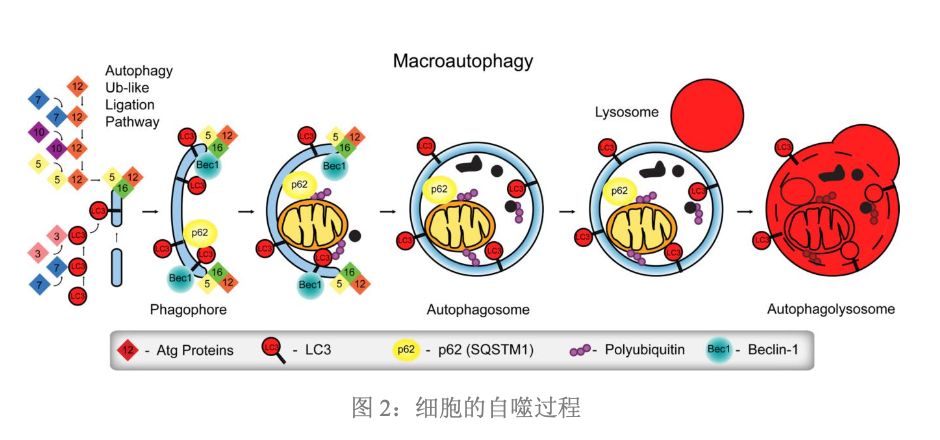
- 自噬的发生和发展,受到多种相关基因的调控,至少已经鉴定出30多种相关基因
- 由于自噬领域的研究历史非常漫长,早先形成的习惯性用法惯性很强大,因此,即便到了现代,很多习惯性用法,包括分子的命名,仍然大行其道,这给我们在文献阅读和了解自噬领域的最新进展时会造成一定的困扰
根据细胞自噬的发生过程了解分子机制
- 在这一部份中,我们会把细胞自噬的第一阶段,也就是“双层分隔膜形成阶段/启动阶段”细分为两个小阶段,分别是自噬的诱导阶段Regulation of Induction和成核阶段Vesicle Nucleation;我们把细胞自噬的第三阶段,也就是“自噬溶酶体的形成与裂解阶段”细分为两个小阶段,分别是自噬溶酶体的形成阶段和自噬溶酶体的裂解阶段
- 无论是把自噬的过程分为3个阶段还是5个阶段,都是人为的分割,实际上自噬是连续的细胞学变化过程
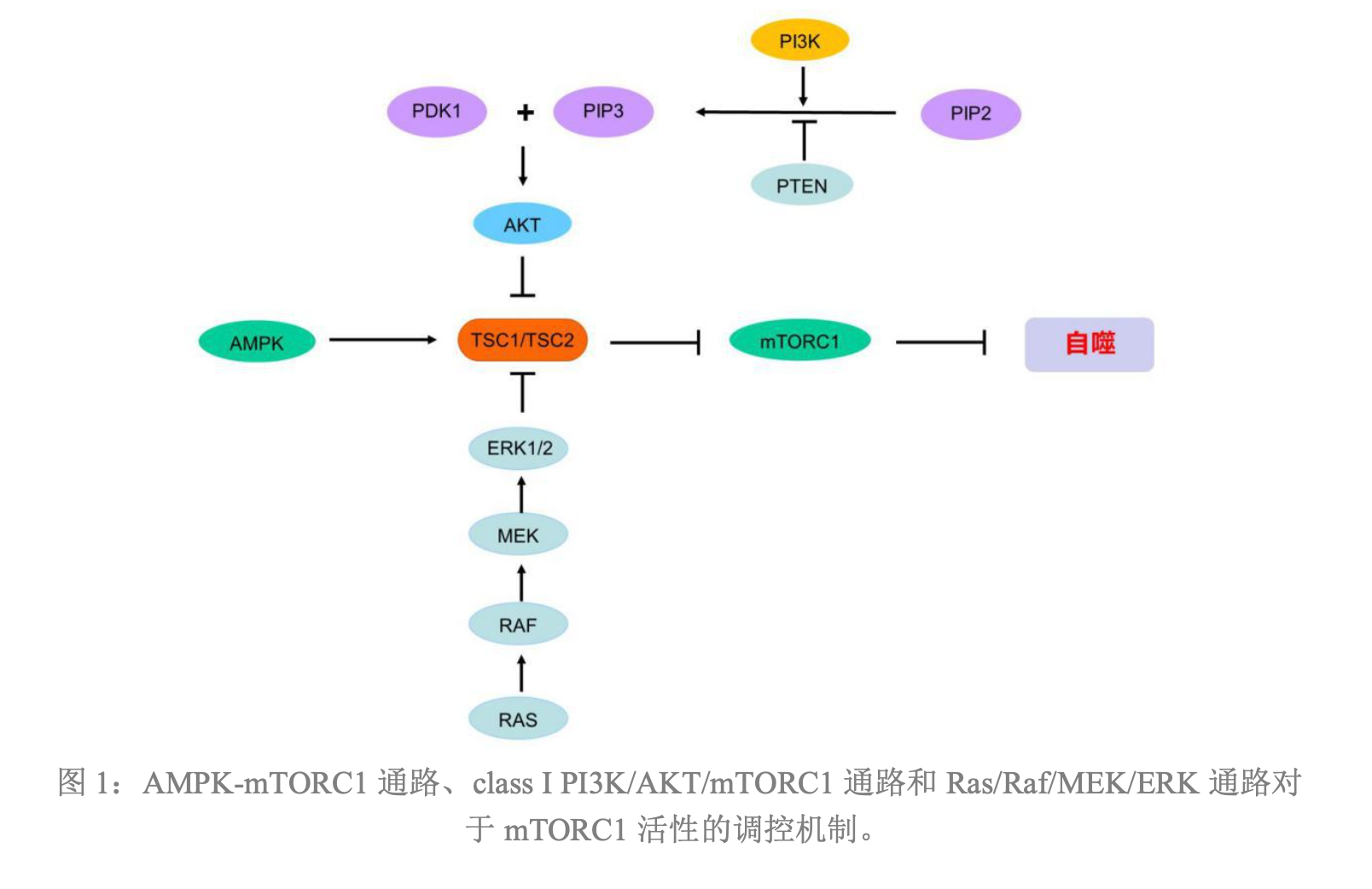
- mToRC1属于自噬过程的起点,因为在正常细胞内,mToRC1处于激活状态,磷酸化Atg13,抑制Atg1-Atg13-Atg17复合物的形成,也抑制了细胞的自噬过程;只有当细胞在营养和能量缺乏,蛋白质积累或者应激状态下,mToRC1的活性才会受到抑制,Atg13的磷酸化水平才会降低,从而导致自噬水平迅速被诱导上调
- 细胞内信号通路如果可以影响mToRC1的活性,那么就能调控下游自噬的过程。
自噬诱导阶段Induction
- 正常生理状态下,细胞保持很低的基础自噬水平,这时细胞内能量充足,哺乳动物雷帕霉素靶蛋白复合物1(mToRC1)处于活化状态,活化的mToRC1使Atg13发生磷酸化,从而抑制细胞的自噬
- 当细胞处在营养和能量的缺乏,蛋白质积累,应激等状态下,mToRC1的活性会受到抑制,Atg13的磷酸化水平降低,从而导致自噬水平被迅速诱导上调
- 哺乳动物的自噬诱导过程,主要通过Atg1复合物来介导。Atg1复合物除了包含Atg1之外,还包含Atg13和Atg17。Atg1复合物形成的主要原因是,由于在营养和能量缺乏、应激状态等条件下,mToRC1的活性受到抑制,使得Atg13的磷酸化水平降低,导致去磷酸化的Atg13与Atg1形成复合物,并且与Atg17相互作用,最终形成Atg1-Atg13-Atg17复合物,并且诱导下游自噬体的成核nucleation和延伸elongation
- Atg1在哺乳动物中的同源蛋白是ULK1,所以Atg1复合物也会被称为ULK1复合物;Atg17在哺乳动物中的同源蛋白是FIP200
成核阶段Vesicle Nucleation
- 和Vps34-Atg6复合物密切相关,这个复合物还包含了调节性蛋白激酶Vps15,共同作用于膜泡的成核,介导PAS(前自噬体结构,pre-autophagosomal structure)的形成
- Vps34-Atg6复合物还可以招募Atg12、Atg5和Atg16多聚体,以及LC3,并通过后两者吞噬泡的伸展和扩张,Vps34在哺乳动物中的同源蛋白是Class Ⅲ-PI3K,Atg6在哺乳动物中的同源蛋白是Beclin-1,所以Vps34-Atg6复合物在哺乳动物中也被叫PI3K-Beclin-1复合物
自噬体延伸阶段
- 哺乳动物自噬体的延伸主要依赖两个类泛素化的系统,分别是Atg12的结合过程和LC3的修饰过程
- Atg12的结合过程是类似于泛素化的过程,需要泛素化酶E1和E2的参与
- Atg12首先由E1样酶Atg7活化,再通过E2样酶Atg10转运并结合Atg5,然后与Atg16结合,形成Atg12-Atg5-Atg16多体复合物,这个复合物定位于前自噬体结构外膜的表面,并参与前自噬体外膜的扩张
- LC3在酵母中的同源基因是Atg8,LC3的修饰过程同样需要类似泛素化酶E1和E2的酶参与,LC3前体形成之后,被Atg4加工,形成胞浆可溶性的LC3-1,然后在E1样酶Atg7和E2样酶Atg3的作用下,和磷脂酰乙醇胺PE形成共价连接的LC3-PE,也就是我们通常所说的LC3-2,并且参与自噬体膜的延伸
- LC3-2能与新形成的膜结合,直到自噬溶酶体完全形成,因此LC3-2常常用作自噬形成的标志物,也是一种重要的、定位于自噬泡膜上的、多信号传导调节蛋白
- 哺乳动物的Atg12、Atg5类泛素化过程和LC3类泛素化过程并不是独立运行的,它们之间可以相互作用和相互调节
自噬体的成熟
- 主要是指自噬体通过微管系统,在转运必须内吞体分类复合物ESCRT和单体GTP酶RabS得作用下,与溶酶体融合,形成自噬溶酶体的过程
- 参与的溶酶体相关蛋白还包括:LAMP1、LAMP2和UVRAG(紫外线抵抗相关肿瘤抑制基因)
自噬体的裂解阶段
- 自噬溶酶体膜的裂解,以及内容物在溶酶体中降解的过程
- 降解过程中产生的AAs和部份蛋白可以为细胞提供营养,能量或循环利用
- 部份自噬蛋白在降解阶段同样发挥了重要的作用,例如Atg22直接参与了一部份氨基酸的运输,同时Atg12和Atg15可能参与了自噬溶酶体的裂解,还有Atg1和Atg13可能参与了溶酶体水解酶的转运
酵母、人和小鼠体内,自噬相关基因的对应表

自噬的检测手段
电镜观察自噬体和溶酶体的超微结构
- 检测自噬的重要方法,在超微结构下,自噬体是包裹有胞质组分,比如线粒体,以及片段化内质网的双层膜结构,通过电镜能从形态学结构很好地鉴别自噬体
- 但是随着研究的深入,已经发现了很多细胞特异性的自噬现象,比如线粒体自噬mitophagy,核糖体自噬ribophagy,这些具有特殊性的自噬体从结构和形态上,都和经典自噬体(包裹细胞内物质和病原微生物)极为类似,通过电镜很难区别这两者的差异
- 另外,在自噬溶酶体的形成过程中,自噬体和溶酶体融合形成的,包裹有细胞内组分的膜结构,在早期阶段可以判断出溶酶体内包裹的组分来源,但是随着组分被降解,很难再通过电镜判断组分的来源;
- 通过电镜很难区分细胞内的自噬溶酶体和内吞杂食泡
- 综上所述,电镜不是检测自噬的完美方法
生化检测自噬体膜标志性蛋白
- 主要指Atg12、Atg5和LC3
- Atg12和Atg5在翻译后就会共价结合在一起,定位在自噬体双层隔离膜的起始和整个延伸阶段
- LC3是酵母中Atg8在哺乳动物中的同源蛋白,和Atg12、Atg5相比,LC3-2除了定位在自噬体形成起始阶段的隔离膜上,也存在于自噬过程中其他各个阶段的,自噬溶酶体的内外膜上
- 尽管LC3-2的分子量大于LC3-1,但由于其分子间存在极强的疏水作用力,SDS-PAGE时LC3-2泳动的速度是大于LC3-1的,所以我们会检测到两条条带,上面的是LC3-2,下面的是LC3-1
- 由于Atg12和Atg5只存在于自噬早期阶段的双层膜上,而且LC3在自噬过程中不断被剪切和降解,所以很难单纯依据此,判断集体自噬是否被激活或者抑制
荧光显微镜检测
- 主要的目标是LC3或GFP-LC3斑点的形成
- 荧光显微镜下观察并定量LC3斑点是一种广泛应用的自噬检测手段,新形成的LC3在细胞质内迅速被Atg4切割,形成LC3-1,LC3-1在泛素样酶催化作用下,随之与膜结构上的磷脂酰乙醇胺PE结合,形成LC3-PE,也就是LC3-2
- 和LC3-1不同,LC3-2在自噬体的内膜和外膜上都有定位,自噬体和溶酶体融合之后,外膜上的LC3-2被Atg4切割并释放,进入下一步循环,而内膜上的LC3-2会被溶酶体降解,所以溶酶体内LC3的含量很低
- 正常情况下内源性LC3或绿色荧光蛋白GFP标记的LC3转染细胞后,在没有自噬发生时,在细胞溶质内表现为弥散状态;外来刺激激活自噬后,细胞内产生大量自噬体,内源性LC3或外源性GFP-LC3在自噬体膜上表现为斑点状态,而在对照细胞内,单独转染GFP时,细胞内绿色荧光无规则分布
- 该方法的缺陷:进行实验操作时主观性比较强,还有实验过程中容易出现因为LC3或GFP-LC3过表达,进而形成大片的异常光斑,进而无法区分自噬体的形成和异常的LC3光斑
生化检测自噬底物p62
- p62被认为是一种自噬特异性底物,其通过与LC3相互作用,渗入到自噬体,并且通过自噬溶酶体,实现有效的降解;因此,p62的表达量的变化,也可以用于自噬的变化
- 在自噬缺陷的细胞中,p62的水平不降反升,由此证明细胞内总p62水平和自噬活性密切相关
- 此法的缺陷:自噬不是降解p62的唯一途径,p62的表达水平还受到机体内多种机制的调控,自噬诱导条件下,还可以通过转录水平对p62进行调节,因此单纯通过检测细胞内p62水平来判断细胞内自噬进行的程度也是存在缺陷的
检测长寿蛋白的批量降解
- 根据自噬机制主要负责降解长寿蛋白的特性,先让细胞在含有同位素标记的氨基酸,比如C14或H3标记的Val或Leu中生长一段时间,细胞在此期间合成的蛋白质都将被同位素标记,然后换成不含同位素的培养基,让一些被标记的短寿命蛋白通过蛋白酶体途径降解
- 在自噬诱导之后,通过检测培养上清中释放的自噬性降解产物的放射性活度,即可反应细胞自噬性降解的能力,如果同时加入自噬激活剂和抑制剂,就更能反应自噬引起的蛋白质降解了
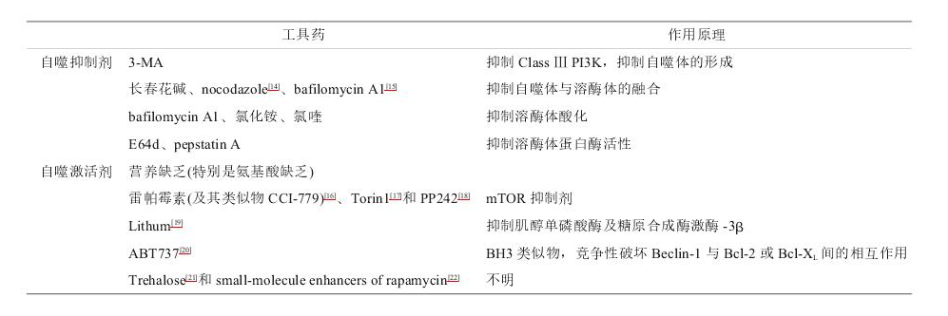
补充:常见的自噬激活剂和抑制剂
自噬的生理和病理意义
自噬的生理功能
- 细胞自噬作为细胞内能量的来源,在维持能量代谢及应对应激改变时起着重要的作用。 细胞在营养缺乏、应激状态下,通过上调细胞自噬分解更多蛋白质,来提供细胞存活需要的 能量。
- 细胞自噬在维持细胞稳态中也发挥了关键作用。细胞自噬通过对长寿蛋白、细胞器的降解利用以及清除缺陷蛋白的积聚,来参与细胞内细胞质的重建和维持细胞稳态。细胞自噬负调控了细胞老化过程中的部分蛋白质、细胞器等的积聚,这也提示了细胞自噬与生命长度的相关性。
- 细胞自噬引起的细胞程序性死亡(II型程序性细胞死亡),在体内清除无用或病理改变的 细胞过程中起着重要作用。细胞正常的自噬水平的破坏与肿瘤、自身免疫性疾病等关系密切。
自噬与疾病
细胞自噬与肿瘤
- 细胞自噬与肿瘤有着非常密切的关系。人类众多癌细 胞中都能发现细胞自噬相关基因的缺失,例如 Beclin-1 在很多乳腺癌细胞中明显表达降低, 可见细胞自噬可以抑制肿瘤的发生。
- 细胞自噬与肿瘤的关系非常复杂,它在肿瘤的发生发展过程中扮演着双重角色。在肿瘤发生的早期,抑制细胞自噬可以促进肿瘤细胞的增长,显示细胞自噬可以抑制肿瘤的发生;但在肿瘤的进展过程中,细胞自噬却可以抑制肿瘤细胞的凋亡、促进肿瘤细胞的转移,从而使肿瘤细胞持续增殖;同时,细胞自噬还能通过促进血管生成来促进肿瘤细胞的生长。
- 在肿瘤的治疗过程中细胞自噬也有双重功能。一方面,可以保护肿瘤细胞免受化疗、放疗的损伤,另一方面,又可以因为抗肿瘤药物的影响,诱导肿瘤细胞的程序性凋亡。
- 因此,自噬和肿瘤之间的调控关系具有双向性和复杂性,往往由于肿瘤细胞所处的阶段、细胞内信号调控通路的差异甚至细胞周围的微环境的变化,而发挥了不同的效果。
细胞自噬与病原体
- 进入人体内的细菌、病毒可以被自噬体包裹并运送至溶酶体,从而 通过细胞的自噬过程而降解。
- A型链球菌又被称为化脓性链球菌,是人类细菌感染中最重要的病原之一。引起的感染主要 有急性咽炎、急性扁桃体炎,也可致肺部感染、猩红热、皮肤软组织感染,并可导致全身性感染。实验表明,细胞自噬相关基因Atg5缺失的细胞中,A型链球菌可以大量繁殖,说明细胞内的自噬相关基因Atg5具有抑制A群链球菌的作用。
- 另外,EB病毒具有在体内外专一性地感染人类及某些灵长类B细胞的生物学特性。机体可 以通过细胞自噬与MHCII类抗原的相互作用,清除进入体内的EB病毒。
细胞自噬与神经性退行性疾病、肌病
- 细胞自噬广泛参与机体神经元内的异常蛋白的降解,当细胞自噬水平的上调或下调时,可以引起神经系统功能障碍,比如Huntington’s(亨廷顿病性痴呆)、Parkinson’s(帕金森综合征)、Altheimer’s(阿尔兹海默症)。
- 另外,肌细胞中细胞自噬相关蛋白的缺陷可导致大量自噬溶酶体的聚集,而引起肌病,比如 Danon 肌病。
- 最后,相关实验还表明,细胞自噬与糖尿病肾病、心脏疾病也存在重要的联系。








