血管新生总论
分清楚三个词
- genesis——新生,生成
- angiogenesis——血管新生,”angio”来自希腊语,愿义为“血管、容器”,后来引申为“被血管围绕,被血管覆盖”,关键在于“新”,强调在原有的毛细血管或微静脉的基础上,通过内皮细胞的增殖、分化和迁移,以芽生或非芽生的形式,生成新生的血管的过程,强调血管“从少到多”的过程,参与了很多生理或病理过程,比如胚胎发育、女性生殖周期、胎盘发育、糖尿病视网膜血管增生、创伤愈合、肿瘤血管生长等过程。
- vasculogenesis——血管发生,在胚胎时,由中胚层起源形成血管的过程中,由成血管细胞发育成血管内皮细胞,并最终形成血管的过程,是血管从无到有的过程。
- arteriogenesis——动脉生成,指新生成或原有的血管沟发生重构,形成更大并肌组织化的小动脉或者侧副管(侧枝循环?),在心肌缺血动物模型和冠状动脉缺血患者中比较常见
- 在中文语境中,“血管新生”和“血管生成”通常不做严格的区分,但是我们需要注意的英文单词不同,含义也不同
血管新生的分期
初期
- 多种体内、外刺激使得促血管生成因子分泌增加,在局部积聚,从而诱使血管新生现象的启动
- 能够诱使这一现象的刺激:血管损伤、创伤、肿瘤生长、局部炎症反应和某些细胞因子等
增生侵入期
- 这一阶段发生的变化:蛋白酶降解细胞外基质ECM,使内皮细胞摆脱被周围组织粘附的状态,促进内皮细胞的增生、迁移和浸润
成熟分化期
- 这一阶段发生的变化:血管腔形成,内皮细胞分化、血管结构进行“整修和改建”,毛细血管网可以根据组织需要进行进一步增生、从而使得毛细血管网密度变大,或者毛细血管网退化、使得毛细血管网变得稀疏,最终形成成熟的血管网络
新生血管的生长方式
- 脑组织中以芽生式为主、肺血管中以非芽生为主
- 很多疾病的发生发展中,都会出现微血管异常生长的现象,表现为血管新生过度、缺陷或者收到抑制
芽生式
- 新生的毛细血管在原有的毛细血管上“出芽”,分头呈线性生长的血管生长方式
- 一些促进血管新生的因子,比如VEGF,常常作为趋化因子,指引新生血管出芽生长的方向,也就是说,出芽生长的血管的尖端,往往指向分泌VEGF的方向
非芽生式
- 原有的毛细血管被横贯血管的间质突起,纵向一分为二,变成两条新的毛细血管
- 在发生非芽生式的血管新生之前,被分割的毛细血管常常发生内皮细胞的增生、管腔变大的现象
套入式
- 在血管新生的过程中,已有的、较细的毛细血管,呈柱状插入较粗的血管管腔内,在整个过程中不需要内皮细胞的出芽,最终形成了“大管套小管“的嵌套模式,类似于俄罗斯套娃
- 也有一些学者会把套入式血管新生归纳入非芽生式血管新生模式中的一种特殊新生
血管新生的现象与疾病的关系
存在血管新生现象增加的疾病
- 肿瘤
- 糖尿病视网膜病
- 血管瘤
- 类风湿性关节炎
存在血管新生现象减少的疾病
- 冠心病
- 心肌梗死后
- 脑梗塞后
- 血管闭塞性血栓性脉管炎
血管新生与肿瘤的关系
- 肿瘤在生长、转移等生物学行为中都和微血管增生有密切的关系。无论原发性或转移性肿瘤,持续性的生长都必须依赖新生血管的形成。缺少血供的肿瘤,直径一般只能维持在1~2 mm以内。
- 肿瘤的生长可以分为两个时期
- 血管前期(Pre-vascular phase),这一时期是无血管生长期。
- 肿瘤增殖到大约直径2mm后,进人血管期(Vascular phase):这一时期以肿瘤组织中毛细血管的进行性生长为标志。新生的毛细血管为迅速增长的肿瘤组织运送氧气和养料,并将代谢废物运走。
- 在这一时期,肿瘤组织增殖迅速。肿瘤组织中的血管是由邻近组织中小血管壁芽生并向肿瘤组织内部生长成熟的。虽然肿瘤组织内的新生血管来源于周边正常组织内的正常血管,但是肿瘤内的新生血管和正常组织的血管,在结构和细胞组成上有很大的差异。 肿瘤新生血管只有一层内皮细胞,没有平滑肌和神经末梢。
- 肿瘤内新生血管的四个阶段
- 血管生长形成期:肿瘤组织启动促进血管形成的遗传信息进行表达。内皮细胞和周细胞都含有形成血管腔隙并分支连接,形成毛细血管网的遗传信息。血管新生过程开始之后, 肿瘤组织通过调节促进与抑制血管形成的物质的含量与比例,诱导新生血管的生成。
- 基底膜降解期:肿瘤组织内启动了血管形成机制。最初表现为母血管在促进血管新生因子的作用下管腔扩张;同时由周围细胞产生的胶原酶和纤溶酶原激活物降解母血管的基底膜和局部的基质,从而促进了内皮细胞发生迁移
- 内皮细胞迁移期:基底膜发生形态变化的同时,在血管生长因子作用方向上,内皮细胞发生趋化性生长和迁移,表现为一个或多个细胞从母血管壁的周围组织中长出。周细胞环绕内皮细胞,同样发生增生和迁移,而且周细胞的出现可抑制内皮细胞的过度分裂和迁移。
- 管腔形成期:内皮细胞向肿瘤组织延伸的过程中,内皮细胞之间逐渐形成裂隙样腔隙, 同时内皮细胞发生形态改变,被拉长成管状。这些新形成的管状腔隙与母血管的腔隙相连。 此后,这些腔隙互相连接并形成毛细血管网,并在内皮细胞和周细胞的外围出现基底膜,最终形成新生的血管。
血管新生的调控
血管新生的平衡学说
- 在正常情况下,血管新生的诱导与血管新生的抑制处于平衡状态,一旦这种平衡被打破,就会刺激血管系统以出芽的方式,形成新生的血管;或者,抑制血管系统
- 在整个血管新生过程中,血管既受到血管诱导因子的调控,也同时受到血管抑制因子的调控,这两种功能相反的因子的平衡,使血管处于正常的生长状态
血管新生诱导因子
- 促进血管的新生过程
- 常见的(括号内为对应的受体):VEGF(VEGFR)、Angiopoietin(Tie-2)、FGF(FGFR1-4)
VEGF
- 最早于1983年,由Sanger等人发现,最初被称为血管通透性因子VPF
- 1989年的进一步研究表明,VEGF可以特异性促进血管内皮细胞的有丝分裂,随后才改名为了VEGF
- VEGF是血管内皮最具有特异性的生长因子,是一个含有信号肽的分泌型,肽性生长因子;VEGF是正常血管发生和血管新生必要的调节因子
- VEGFR属于酪氨酸激酶受体TKR,目前发现有3种VEGFR,分别命名为VEGFR1-3,其中VEGFR1是最有效的有丝分裂受体,在病理性促炎症反应的部位募集造血前体细胞和单核细胞时起到关键作用,并且促进了血管新生
Angiopoietin
- 又被称为“促血管生成素”。它含有两个家族成员:Ang-1和Ang-2,是由血管内皮分泌的调控血管生成的一组生长因子,主要作用是调控血管成熟和重塑。
- Ang-1是最常见的血管生成素,它和内皮细胞特异性酪胺酸激酶受体 Tie-2相结合。Ang-1广泛表达于胚胎和成人,在体内 Ang-1 主要作用通过促进内皮细胞与周围支持细胞的交互作用和黏附,从而促进并维护已形成的血管的完整性,同时在血管新生活跃期刺激新血管的形成。
- Ang-2在人类和鼠类中选择性表达于卵巢、子宫和胎盘等组织内,主要作用是降低细胞与基质、细胞与细胞之间的联系。同时Ang-2通过与 Ang-1竞争性结合Tie-2受体,从而阻断Ang-1的作用。Ang-1和Ang-2之间存在竞争性结合Tie-2受体的现象。低氧环境可以刺激Ang-2表达;在肿瘤相关的病理性血管新生形成过程中,也有Ang-2表达增加的现象。
- Tie-2为酪胺酸激酶受体,大量表达于内皮细胞,在血管新生和血管维护中起重要作用。Tie-2的配体既可以是Ang-1,又可以是Ang-2。配体激活作用是浓度依赖的形式。研究表明Ang-2激活Tie-2的能力较弱;而 Ang-1激活Tie-2的能力较强。但是在某些病理条件下,例如在肿瘤血管新生的过程中,Ang-2的表达显著升高从而使Ang-2替代Ang-1发生和 Tie-2的结合,并介导下游的血管新生过程
FGF
- 也就是成纤维细胞生长因子。
- FGF是一大类蛋白家族,都是分子量很小的多肽类生长因子。它们拥有共同的特定结构,多数可与肝素结合,大多数FGF包含有分泌信号肽,并且被分泌到细胞外环境中,而且可以和细胞外基质中的乙酰肝素氨基葡聚糖结合
- FGF的家族成员,到目前为止,已经发现有20个,其中FGF-1和FGF-2是有明确的促血管形成的分子。另外,FGF-3和FGF-4在鸡绒毛膜尿囊膜相关实验中被证实有诱导血管新生的作用;FGF-7虽然被认为是上皮细胞促分裂因子,但是在鼠角膜体内实验中证实,FGF-7具有血管形成作用
- FGF受体属于酪胺酸激酶受体,包含有2-3个免疫球蛋白样结构域和一个肝素结合序列。到目前为止,一共发现4种FGF受体 (FGFR1-4),其中在 蛋白水平显示,FGF 受体(FGFR1-4)有55%~72%的序列同源性,提示 FGF的不同受体, 很可能介导类似的信号传递通路,促进新生血管的形成。
血管新生抑制因子
- 抑制血管新生过程
- 常见的血管新生抑制因子:Arresten、Endostatin、Angiostatin、MMPs
Endostatin
- Endostatin是ⅩⅧ(罗马数字18)型胶原衍生的血管新生抑制因子,分子量大概是20KD,是这个胶原分子C-terminus的一个多肽片段,
- 人的Endostatin单体呈现球形结构,分子内部含有两个二硫键,其N-terminus含有一个Zinc Binding Domain(ZBD),另外还含有一个富含精氨酸的结构域(Arginine-rich domain,ARD),Endostatin通过ARD与肝素heparin结合
- Endostatin最早在小鼠中血管内皮细胞体外培养上清被发现,具有强大的抑制血管新生的能力;在动物模型中证实,重组的Endostatin可以有效阻碍血管新生,有效抑制原发肿瘤的进展和转移
- Endostatin的作用机制:可能包括干扰FGF-2诱导的信号转导途径,阻碍内皮细胞活力,诱导内皮细胞发生凋亡,同时,Endostatin可以下调大量,与内皮细胞生长相关的基因的表达
- 当Endostatin表达升高时,血管内皮细胞中促血管生成的若干条信号途径被抑制、抗血管新生通路被上调,从而实现抑制血管生成的效果
Arresten
注意:还有一个分子的发音和Arresten是几乎一样的。这个分子叫 Arrestin。 这两个分子的差别在于最后三个字母,我们提到的Arresten 最后三个字母是 ten,而另一个分子最后三个字母是tin。这两个分子拼写太接近,在看文献的时候,要多加注意。
- Arrestin这个分子的另一个名称是Col4A1,全称是Collagen alpha-1(IV) chain。它由13号染色体上的COL4A1基因编码。COL4A1/Arresten 蛋白是IV型胶原的一个亚基,分子量为26KD。
- Col4A1/Arresten 被证实有抑制血管新生的作用。研究证明 Arresten 能选择性抑制内皮细胞管道形成,并且还能抑制内皮细胞增殖和迁移。Arresten相关治疗的动物试验证明,它能显著降低肿瘤的肺转移,并抑制大、小细胞性肾癌肿瘤生长。
- 现有证据表明 Arresten 作用途径可能经由α1β1 整联蛋白(也就是 integrinα1β1),并阻碍它和 I 型胶原结合,也可能通过和硫酸乙酰肝素蛋白多糖直接结合而产生作用。
Angiostatin
- 纤维蛋白溶酶原蛋白溶解产物,其分子量在38—45kDa,具有抗血管新生的作用。
- Angiostatin 是纤维蛋白溶酶原的一个片段。纤维蛋白溶酶原分子含有5 个 kringle 结构域,其中第1个到第四个kringle结构就是angiostatin。
- 有意思的是,纤维蛋白溶酶原本身不具备血管新生的抑制作用
- Angiostatin有许多作用靶目标,可以和内皮细胞表面的ATP合成酶直接结合从而触发内皮细胞发生凋亡,其机制可能是降低细胞内的pH值。 Angiostatin对于缺乏生长因子刺激的内皮细胞有促进凋亡的作用,但对于细胞的增殖没有影响,Angiostatin 还能抑制内皮细胞的迁移和管道形成。
基质金属蛋白酶MMP
- 其你能水解细胞外基质的多个组成成分,参与血管新生基底膜和 ECM(细胞外基质,extracellular matrix)的重塑。
- 按照传统观点,大部分学者认为 MMP 属于血管新生抑制因子。有研究发现,某些特定的MMPs比如MMP-12等具有抗血管新生作用,它的主要作用途径是通过蛋白裂解的作用方式,降解特定的胶原链和纤溶酶原,从而产生内源性的血管新生抑制因子,并且可以调控细胞受体信号途 径。
- 某些MMPs,比如MMP-7等已证实具有促血管新生作用,它的主要作用途径是除去血管新生过程中的周细胞,释放 ECM(细胞外基质)内含有的促血管新生因子,暴露结合在ECM(细胞外基质)中的促血管新生的整联蛋白 integrin,产生促迁移的细胞外基质片段, 弱化内皮细胞和细胞外基质之间的粘附。
血管新生中的信号通路:VEGF信号通路
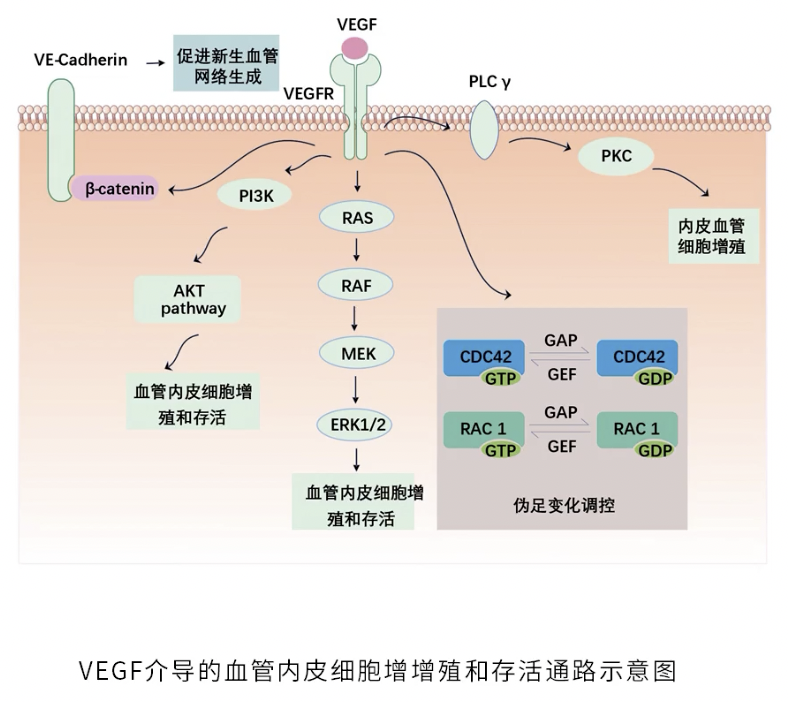
- VEGF介导的级联信号放大过程,参与了血管新生的各个过程,在很大程度上决定了血管发生的结果
- 血管新生是一个多步骤的连续过程,VEGF介导的信号通路在整个血管新生过程中通过下游不同的信号,介导了血管新生过程中的不同生物学过程
VEGF调控内皮细胞的增殖和存活
- 主要通过下游的PLCγ1通路,MAPK通路和PI3K-Akt信号通路,来促进内皮细胞的增殖和存活
- 具体作用机制如上图所示
- VEGF-PI3K-Akt也被称为VEGF经典信号通路,可以促进内皮细胞的增殖和存活,PI3K-Akt信号通路的下游途径包括了抗凋亡蛋白Bad,同时通过mTORC2和FOXO1促进内皮细胞的增殖和血管的新生
VEGF通过Rho家族蛋白调控伪足的形成
- 形态学研究提示,在血管新生过程中,内皮细胞会形成特殊的生长结构,称“伪足”
- 伪足从形态上可以分为2种,分别是处于细胞最前端的,呈现细丝状的“丝状伪足”,另外一种是连接丝状伪足和内皮细胞胞体的,较为宽大的“板状伪足”
- 伪足在结构上主要由F-actin主导:丝状伪足上的F-actin以线性排列,板状伪足上F-actin有较多分支,形成有一定支撑能力的网状结构
- Rho家族属于小GTPase家族之下的亚家族,在丝状伪足上,Rho家族蛋白CDC42高表达,而板状伪足上Rho家族的另一个成员Rec-1高表达
- 丝状伪足和板状伪足都是高灵敏的结构:它们在血管内皮细胞接收到VEGF信号之后,几分钟之内就会产生,并且发生形态学的变化;在整个过程中,GAP和GEF这两类分子发挥调控作用
- GAP:GTPase Activating Protein,功能是抑制Rho家族的活性;GEF:Guanine Nucleiotide Exchange Factor,作用是增强Rho家族的活性,也就是两者对Rho家族的蛋白的活性是相互拮抗的,在血管内皮细胞内,当VEGF信号通路激活后,通过调控GAP和GEF之间的关系,从而激活或抑制Rho家族的成员的活性,调节血管内皮细胞上丝状伪足和板状伪足的动态变化过程
VEGF通过β-catenin和VE-cadherin复合物促进血管网络的形成
- 血管内皮细胞在VEGF的作用下,产生大量丝状伪足,相邻微血管的丝状伪足通常黏连在一起,从而引导微血管形成环状血管结构;大量微血管之间相互交错,形成微血管网络
- 通过丝状伪足的ECM粘附区域,VEGF可以和ECM形成黏附作用,这一过程中最重要的分子是钙黏素VE-Cadherin(VE-vasculoendothelial)
- VE-cadherin的表达,很大程度上依赖于VEGF对血管内皮细胞的激活作用,激活的血管内皮细胞膜上,VE-cadherin的表达会迅速升高
- Wnt信号通路中的卷曲蛋白Frizzled(一个7次跨膜的膜蛋白),β-catenin也参与调控VE-cadherin:在Wnt通路激活的状态下,Frizzled和β-catenin可以上调细胞膜上VE-cadherin的稳定性,从而促进新生血管网络的稳定,有利于更多新生血管网络的形成
- β-catenin的表达同样受到VEGF的影响:在血管新生的过程中,随着VEGF的表达升高,β-catenin的表达也相应升高,从而促进更多VE-cadherin/β-catenin复合物的形成,有利于VE-cadherin在细胞膜上的稳定,促进新生血管网络形成
血管新生相关实验
- 很多疾病发生过程中,都会出现微血管异常生长的现象:肿瘤、糖尿病视网膜病变,血管瘤、类风湿性关节炎等
- 抑制血管新生已经成为治疗这些疾病的重要策略之一,寻找血管新生抑制剂也早已成为制药领域的热点
- 血管新生的许多过程,例如内皮细胞的增殖、迁移、毛细血管网结构的形成等,都可以在血管新生模型中加以模拟和完成
体外模型
内皮细胞增殖实验
- 内皮细胞的活化和增殖是血管新生的启示阶段
- 两种测定细胞增殖的方法
- 内皮细胞数量的测定:同二十四型 Lesson 1中介绍细胞增殖的方法是类似的,主要是MTT比色法或其他,如CCK-8比色法等
- 细胞周期分析:同二十四型 Lesson 2,主要的是BrdU渗入法,PI染色结合流式细胞学检测
内皮细胞迁移实验
- 细胞损伤模型/划痕愈伤实验:在血管内皮细胞的培养皿上,用刀片或其他尖锐物体划出“井”字形区域;经过PBS洗涤之后,再用含0.1%凝胶的MEM培养一段时间;细胞用甲醇固定后进行Giemsa染色,在光镜下技术从损伤边缘迁移出来的细胞数目
- 转移小室模型:上下两层组成,两层之间有胶原包备的、多孔的、多聚碳酸盐滤膜;血管内皮细胞放于上层,加入待测定的药物或者细胞因子,共同培养若干小时之后除去上层的细胞,下层细胞用甲醇固定,HE染色,光镜下计算下层的细胞数
- 转移小室模型对药物或者细胞因子的浓度梯度很敏感,但是计数方法的不同可能会造成统计结果的差异比较大,因此有必要建立严格的计数标准,以减少因为方法不同产生的误差
- 细胞损伤模型和转移小室模型不仅可以用来检测血管内皮细胞的迁移,也可以用来检测其他细胞,比如肿瘤细胞的迁移
小管形成实验
- tube formation assay
- 模拟人体内毛细血管生成的过程,包括内皮细胞的出芽增殖和毛细血管网结构形成等步骤,接近人体内血管生成的实际过程
- 在实验中,最常使用的细胞是HUVEC细胞(人脐静脉内皮细胞),内皮细胞在基质胶、纤维蛋白胶、胶原等基质培养的时候,都能形成网状结构,用光镜或电镜可以分析小管间的紧密连接,从而定性或定量分析血管新生的情况
- 需要指出的是,有些非内皮细胞也能在基质胶上形成管腔结构,因此在实验室需要注意血管内皮细胞的纯度,以及由于其他细胞混入导致的实验结果的干扰
- 现在,可以借助计算机技术统计整个孔的小管,以及小管之间的连接数,还有小管的长度和面积,大大提高了实验的通量和结果的准确度
体内模型
角膜微囊实验
- 首先于1974年被用于研究肿瘤的新生血管研究
- 正常角膜本身是没有血管的,可以避免其他模型的干扰,因此诱导角膜的血管新生更加能反映血管新生过程,现在主要采用鼠的眼角膜进行实验,成本大大降低
- 实验中,将实验动物麻醉之后,在角膜边缘处,用虹膜刀植入载体,载体的作用是缓释特定的细胞因子或药物,3-4天后血管可从边缘出芽,7-10天内新生毛细血管进入载体,通过计数载体内的新生毛细血管数和生长率,可以评价药物或者细胞因子对于血管新生的效果
- 在实验过程中,很容易诱发非特异性的炎症反应,很难和肿瘤微血管新生因子刺激而形成的血管新生相区别;而且,模型中微血管新生呈现环状排列,分布没有规律,给定量分析造成了一定的困难
- 现在在研究中,多采用组织相容性比较好,而且较少引起炎症反应的高分子材料制成多聚缓释载体,在载体中加入微血管缓释因子或药物之后再植入角膜微囊,改进后的模型较少引起炎症反应,但是成本会很高
基质胶栓实验
- 1992年建立的基质胶栓模型,matrigel plug essay
- 基质胶是从肿瘤中提取的,主要由基膜蛋白laminin组成,4°C的时候,基质胶是液态的,将血管新生因子或者药物和基质胶混匀之后,注射到小鼠皮下
- 胶在体温状态下会形成胶栓,内皮细胞等迁入胶栓内会形成血管样结构,1-3周后取出胶栓及包围在周边的肉芽组织,再定量胶栓内血管,可以采用测定新生血管内血红素的含量来定量血管新生,但是这种方法没有办法区分新生血管中血窦和大血管的血液,所以也不准确
- 近来的报道(2018年):荧光素标记的高分子葡聚糖来定量新生血管
- 这个模型也可以用来进行组织再生实验,但是很大的缺点是每次注射相同体积的胶液,但是很难得到相同体积的胶栓,也就是基质胶栓模型结果差异较大
- 虽然模型存在上述缺点,但是仍然被广泛用于筛选抑制血管新生药物的实验
鸡胚绒毛尿囊膜实验
- 最早在1931年被报道,1977年首次将用于肿瘤微血管新生的研究
- 鸡胚绒毛尿囊膜实验模型,取材方便、易于观察、实验周期短、实验费用低,适用于大量血管新生药物或因子的筛选
- 模型本身存在一些缺陷
- 植入物渗透压和pH的不同,导致细胞损伤和炎症反应
- 鸡胚内血管纤维蛋白降解产物也可以刺激微血管新生,从而造成假阳性结果
- 鸡胚发育本身存在的血管发生现象也会干扰结果,导致结果可信度下降。
圆盘血管新生系统
- 1988年首次报道
- 将药物或肿瘤细胞悬液加到聚乙烯醇泡沫材料制成的圆盘中央,再将小圆盘植入小鼠胸部或腹部皮下。实验结束后取出小圆盘,石蜡包埋后切片。在显微镜下,可以观察到血管、成纤维细胞及粘连组织。通过计算组织切片中血管交叉点和测定血管内面积,定量新生血管。
- 模型本身也存在一些缺陷
- 植入圆盘后引起的异物反应也能刺激血管形成
- 不能连续和动态地观察小圆盘内血管新生的情况


