- 在上一节课中,我们初步介绍了二元细胞嵌套的逻辑,细胞交互的模式相当于在细胞表型和分子机制中间,在逻辑上又加了一道夹层,提供了一种崭新的维度——我们需要考量变量发挥作用的空间,从一个细胞空间来的变量分子在另一个细胞空间里发挥了功能,某种意义上讲的是一场外星人入侵地球的故事。
- 变量不仅有主次,要分上下游,还要区别是在供体还是受体细胞中执行调控关系,由此构成了文章逻辑层次的最后一层。变量代入恒量是逻辑第一层,多元变量组合是逻辑的第二层,分子交互的直接作用模式是逻辑第三层,细胞交互造成的空间转换是逻辑第四层,可以说在下图的十二宫中,就已经涵盖基础科研中全部的模块化逻辑规则。理解完全之后,三十六策方法论的骨架就算修炼成了。单变量、多元变量间接调控、分子直接交互和细胞交互四层逻辑,也是一个医学科研领军人物的必备素养。
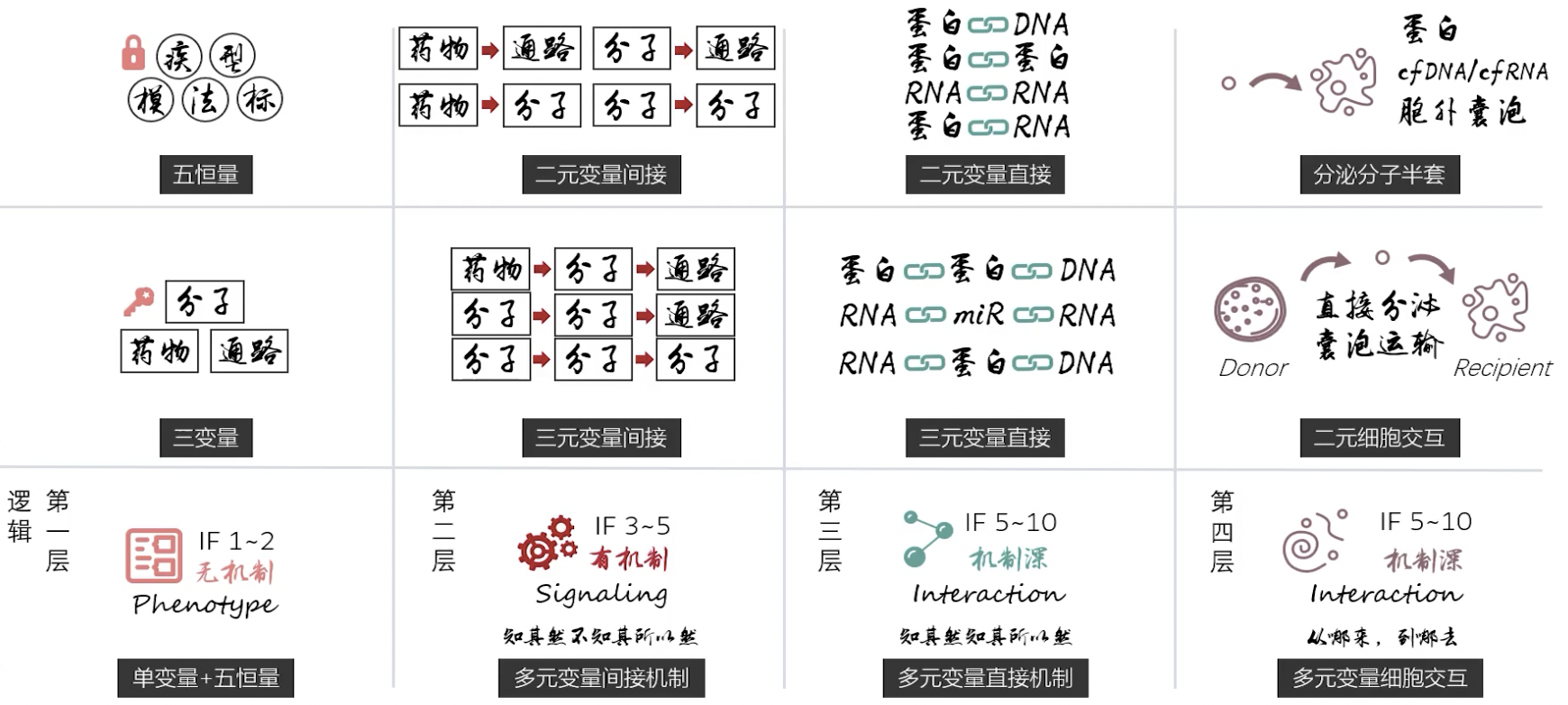
- 细胞交互是一种万能的研究框架,但是涉及到一系列的具体学科领域,我没有办法逐一拆解,我们学习的重点还是要结合自己的问题开展应用,针对自己的研究方向进行知识的拓展。三十六策的内容主要是方法论,方法是宏观的,具体研究工作是微观的,宏观到微观的联接需要自己动脑筋。自己的方向上有哪些细胞的交互通讯能够被研究,这是一个值得挖掘的命题。在上一讲也说到了,掌握了二元细胞结构,文章的影响因子起点就是5以上了,低影响因子的文章根本没必要做复杂的多细胞体系。目标起得高,也要为之付出更多投入,我取法其上得其中,立志突破IF=5这个档次的话,细胞交互就是值得实践的豪华科研套路。文献泛读的技巧要好好领会,学会了泛读筛选文献,速度就很快,模式套的上的典型文献依靠泛读就能找出来,然后自己去精读,总结实验设计,还有模型-实验方法-分子标志的常识。
细胞交互中涉及到的分子类型
- 我们前面梳理过分子这个变量,分子可以分为编码基因的蛋白和非编码RNA两大类
- 蛋白的表达改变要考虑DNA、RNA和蛋白以及转录后和翻译后修饰,一共是5个水平的调控环节。
- 非编码RNA的类型有很多,我们主要关注miRNA、lncRNA和circRNA,这三类非编码RNA分子是当前医学研究中常见的分子变量担当。
- 这些之前讨论过的分子类型,都是可以承担细胞间传递信息的重任的。这节课我们会提到一些新的分子类型,是进入到细胞交互层面的研究才会涉及到的,这些分子主要的角色就是在细胞外进行信号的cross-talk,有时候细胞已经凋谢,但是它的分子信号却可以传递下去,我把它称之为“薪尽火传”,也就是这一策的名字,属于逻辑第四层特有的套路模式。
- 几乎所有的体液中都会有信号分子的存在,特别是在血液中存在的这一类对于疾病的诊断、治疗效果的评价、预后的追踪等都有深刻的转化意义,值得我们投入十二分的关心。我们有一个单独的名称来描述这一类分子,叫循环分子,英文术语是circulating。circulating后跟分子类型,比如circulating miRNA就是循环miRNA,circulating lncRNA就是循环lncRNA。
Circulating蛋白/细胞因子
- 蛋白是执行生物功能的基本单位,用来传递细胞交互信号的circulating蛋白自然是很常见的,这一类蛋白还有一个专有名词:细胞因子cytokine。细胞因子从定义来说,就是一类能在细胞间传递信息的物质,主要包括具有免疫调节的功能性蛋白或小分子多肽。在细胞交互中,免疫相关的表型占了非常重要的位置,免疫细胞天生就具有跟其他组织细胞发生交互的使命。因此我们可以说循环RNA、外泌体之类的课题并不是什么全新的科研套路,这些模式在免疫学的研究中早就被淬炼了无数遍了,无非是套路的延伸而已。
- 对于Circulating蛋白,我们重点去理解细胞因子这类分子的作用模式,细胞因子最早 是从淋巴细胞和单核细胞里面发现的,所以之前是叫淋巴因子或单核因子,随后研究发现很多细胞都能分泌这一类蛋白。尤其当机体遭遇细菌、病毒等微生物的入侵,或者经过物理的、化学的因素诱发了损伤,都会刺激细胞因子的产生,而细胞因子可以杀灭细菌和抑制病毒,达到保护机体的目的。
- 细胞因子已发现的有上百种,根据功能大致可以分成:白细胞介素(Interleukin,IL)、干扰素(Interferon,IFN)、集落刺激因子(Colony-stimulating factor,CSF)、肿瘤坏死因子(Tμmor necrosis factor,TNF)、趋化因子(Chemokine),生长因子(Growth factor,GF)一共六种。
- 细胞因子的功能研究一直是免疫学的一个热点方向,这些蛋白参与的生理过程包括调节T细胞、B细胞活化、生长和分化,介导细胞免疫和体液免疫,刺激造血生成、刺激骨髓祖细胞生长和分化为各种成熟血细胞。同时还可以调节细胞的病理过程,参与抗感染和抗肿瘤,参与组织修复、促进伤口愈合,在超敏反应和自身免疫性疾病中担当角色,人体的发热和炎症都跟它有关。
- 细胞因子是分泌蛋白,但并不是所有的分泌蛋白都是细胞因子,还有消化酶、抗体、多肽类的激素,像生长激素、胰高血糖素、肾上腺素也都是分泌蛋白。分泌蛋白在结构上的一个显著特点是:N-端会有一段特定的氨基酸序列肽段,又叫信号肽,在蛋白转运出细胞的时候,这段信号肽会被剪切掉,形成成熟的分泌蛋白。包含这种序列特征的蛋白就预示着他们是分泌蛋白,所以分泌蛋白是有特殊序列标签的,在基因注释网站检索分子背景信息的时候要对这一特征保持敏感度。
- 分泌蛋白需要结合受体细胞膜上的相应受体蛋白发挥生物学功能,这种配体和受体的结合就是机制研究的一种确定套路。膜上的蛋白也有特定的跨膜结构域,也可以被识别出来,因为蛋白研究相对比较成熟,所以对于一个蛋白在细胞内定位在哪里,是不是分泌以及是不是膜蛋白,全部都有根据序列分析过的结果,在Genecards数据库就有相关的内容。我们了解分子的特定类型,对于基础研究的设计走向尤其是机制的模式具有关键性的影响。
Circulating DNA
- DNA和RNA都是细胞里的,一般情况下他们不会直接分泌出来,如果需要参与细胞交互信号传递,正常采用经由囊泡运输的模式,也就是需要借助载体才能实现从一种细胞到另一种细胞的交互过程。
- 但是,如果细胞破了,也就是细胞自身裂解了,那么其中的DNA和RNA就有可能释放出来。这种DNA和RNA也是circulating的,它们有一个专门的名词,叫cell free DNA,或者cell free RNA,简称cfDNA和cfRNA。cell free的意思就是游离于细胞外,cfDNA和cfRNA是专属于循环分子中的一类,细胞内没有,它们构成了我们医学科研中变量的一种新分子类型。如果我们的研究对象是cfDNA、cfRNA,天生有一种诊断倾向的研究格式,形成了一种独特的研究套路,这部份内容我们在下一节课介绍。
- 人体细胞有自我的新陈代谢过程,每时每刻体内都有细胞会发生凋亡,凋亡是一种主动式的细胞降解,这个过程中会产生片段化的DNA,大小基本在一两百bp左右。除了主动的,还有细胞被动裂解,可以是来源于外界物理或者化学刺激引发的组织坏死,也可以是自身免疫系统对细胞杀伤作用,这个过程释放的DNA片段会比较大。
- 无论是主动还是被动产生的cfDNA,一般到了外周血中都会被快速清除,细胞又会释放新的cfDNA,形成动态平衡。在健康状态下,cfDNA一般是维持在一个较低的水平,人体内检测到的cfDNA含量实际上是DNA的释放和清除平衡后的结果。当严重的系统性组织损伤或者异常代谢打破这种平衡时,大量死亡的细胞释放cfDNA会使血液中的cfDNA含量大大增加,这就跟疾病的临床诊断挂上钩了,很有医学研究的价值。
- cfDNA的发现其实非常早,1948年就已经在人血液中发现了,但是当时对于DNA是遗传物质的认识还没建立,DNA双螺旋结构是1953年提出的,所以发现之后并没有引起很大的研究热情。在1977年的时候,第一次发现肿瘤病人血液中的cfDNA含量要比正常人高。到了1989年,证实了一部分cfDNA是来源于肿瘤细胞的,提出了liquid biopsy的概念,就是肿瘤精准医疗中的液体活检或者叫液态活检的起源。在2013年,在随后的研究中大量发现来自于肿瘤细胞的cfDNA可以检测出肿瘤特异的突变信息,才终于使这种体液活检技术成为能够大范围应用的现实。不难理解的是,传统的病理技术是需要从病灶获得组织,这种检查是侵入式的,没那么安全,有一定局限性。癌症有异质性,对于已经转移的肿瘤而言,仅取某个局部组织并不能反映患者整体情况。有些患者还不具备组织活检的条件,有些肿瘤在受到活检的操作后有加速转移的风险。那么液体活检的样本来自血液,是非侵入式的,就很有想象空间了。
- 当然,来自于肿瘤细胞的cfDNA量不是很大,尤其是早期的肿瘤病人,检测敏感度是个问题。能实现有效检测与最近十几年测序技术的快速发展也有巨大关联,测序技术的通量和精度现在已经很高了,这也是肿瘤的cfDNA被应用于个体化诊断,包括液态活检如今是转化医学热点的原因,这个方向是严重依赖于测序技术作为平台支撑的。
- cfDNA检测的转化应用最知名的案例就是新生儿无创唐筛,在孕妇血液中约有10%-15%的cfDNA来自于胎盘滋养层,这意味着可以通过母亲外周血测序分析了解其中的cfDNA序列,其中一部分信息来源于胎儿。而通过这一部分就可以判断胎儿是否存在整个染色体或者大片段DNA的变异,对于传统的羊水穿刺检测来说是一种颠覆,因为无创。
- 很多炎症性的疾病,因为同样会引发局部细胞的大量死亡,cfDNA水平也会发生显著变化。比如关节炎、肝炎、肾炎、胰腺炎、炎症性肠病、系统性红斑狼疮等疾病患者血液中,检测到cfDNA的量相比健康人大大增加,可以作为Biomarker。
- 在肿瘤中的cfDNA,还有一个专门的名词叫ctDNA,circulating tμmorDNA,循环肿瘤DNA,就是指来自肿瘤细胞的外周血cfDNA。ctDNA中能够检测到非常丰富的遗传变异信息,从位点突变,到基因组结构变异、拷贝数变异都能够检测到。可以想象ctDNA含量通常在晚期或转移性肿瘤中较高,而在早期或局限性肿瘤中含量较低。在不同类型肿瘤中,ctDNA水平也会存在差异,所以具体临床应用要探索,不能一概而论。ctDNA的转化应用潜力是可以作为肿瘤预后的标志物,而且也能够用来预测药物治疗的效果,实现个体化治疗。
- 说到ctDNA,还有一个概念也要了解一下,那就是CTC,循环肿瘤细胞(Circulating tμmor cell)。CTC是从实体瘤中脱离出来并进入外周血液循环的肿瘤细胞,可以用来判断肿瘤的转移风险和病人的预后情况。早在1896年,研究人员就已经从一例转移性的肿瘤患者血液中,首次观察到从实体肿瘤中脱离并进入血液循环的肿瘤细胞,提出了CTC的概念,这种发现靠显微镜就可以了,所以历史很久远了。目前CTC计数可以用来预测一些肿瘤的治疗后无进展生存时间PFS和总生存时间OS,以此作为患者是否需要接受辅助化疗的参考,也可以动态监测CTC,观察接受化疗的肿瘤患者CTC的数量变化,作为肿瘤进展、转移复发风险评估的参考。另一方面可以实时反映肿瘤负荷,作为肿瘤药物耐药性的监测。
- CTC的临床价值还在于可以准确地提示肿瘤的发生,并且因为CTC在肿瘤早期就会产生,所以远远早于影像学证据。但是,从技术上来说,CTC在外周血中含量非常低,在癌前病变或肿瘤早期数目就更少了,检测的灵敏度很难保障。一般患者1ml血中大概平均只有1个CTC,而1ml血液里面有50亿个红细胞和上千万的白细胞,对检测技术是个考验。另外CTC检测还有特异性的问题,血液中一些细胞,比如巨核细胞、内皮细胞、未成熟的造血细胞、上皮细胞等,这些细胞在正常血液中比较少见到,比较容易被误认为CTC。因为我们判断CTC是不是肿瘤细胞是通过表面的Biomarker,理论上说这只能推断这种细胞可能是恶性肿瘤细胞,而不能进一步确诊到底为何种肿瘤细胞。还有没有影像学证据,也没法对症治疗,只能加强随访,这也是局限性。
- 总的来说,ctDNA的灵敏度高于CTC,因为ctDNA半衰期很短,只有几个小时,是实时更新代谢的,可以清晰反馈当前肿瘤信息,有治疗实时监控的潜力。但针对肿瘤早期筛查或诊断,CTC 的准确性优于ctDNA,毕竟早期的时候ctDNA含量太少了。
Circulating RNA/exRNA
- DNA比较稳定,所以cfDNA是比较可靠的循环Biomarker,但是RNA就没那么稳定了,非常容易被降解,因此cfRNA相对而言应用价值就没有那么突出。
- cfRNA的研究也是有的,它的来源跟cfDNA一样,主动或者被动的细胞降解就能释放出来,在血液中的cfRNA又叫循环RNA,circulating RNA,其他的体液也会有,尿液、唾液、乳汁、前列腺液、精液、经血等。这些游离RNA还有个名称是exRNA(extracellular RNA),翻译过来是胞外的RNA,概念很多大家不要慌,有一些只是表述不同,意思其实差不多,我们应当掌握合并同类项的道理。cfDNA、cfRNA、ctDNA、CTC、exRNA都是cell free的,extracellular跟cell free是一个意思。cell free的分子除了近端的作用形式,要进入循环系统那就属于circulating的状态,所以一个分子前面有circulating的定语,你就知道它是cell free的,可以用于液态活检。
总结
- mRNA、miRNA、lncRNA、circRNA都可能出现在exRNA中,通过某些病理过程的特殊机制,这一领域研究还比较前沿,很多问题尚无定论。但有一点是肯定的,就是exRNA更倾向于坐车,用囊泡的形式分泌出来。有了外层膜的保护,RNA的稳定性就有保证了。这一类在囊泡中的RNA分子,尤其是起调节作用的非编码RNA:miRNA、lncRNA、circRNA,加上囊泡中的大热门——外泌体,外泌体携带非编码RNA介导细胞交互作用,这大概是当前这个阶段最具有模式创新属性的课题了,从分子类型到交互模式到逻辑套路都是高配的,高端大气上档次。
细胞外囊泡与外泌体简介
- 细胞外囊泡,英文是extracellular vesicles,简称EVs。
- 大家一说胞外囊泡第一反应是外泌体,其实是有三类常见的EV
- 第一种是凋亡过程产生的凋亡小体(apoptotic body),体积最大,500nm-2μm,它伴随凋亡表型产生,所以只跟凋亡挂钩。
- 第二种是微囊泡(microvesicle)体积在100nm或200nm以上。
- 第三种外泌体(exosome),体积小一点,一般说30-100nm,也有说到150nm的。
- 以粒径大小来区分微泡和外泌体是不太严谨的,就像lncRNA的定义是200nt以上的非编码RNA,但180、190的非编码RNA也是lncRNA。微泡和外泌体的区别还在于它们形成的机制不太一样,凋亡小体和微泡都是由细胞直接出芽形成的囊泡,外泌体的形成却要经历更加复杂的途径,中间要产生一个多囊泡体,因为大家不会去研究外泌体生成机制,所以我也不详细讲,有兴趣自己查资料就好了,只需要知道形成机制上,微泡和外泌体不一样就行。
- 从技术上来说,抽提外泌体的试剂盒也不能保证100%就是外泌体,它只能是把100nm粒径左右的囊泡给富集下来,你一开始就用了外泌体的试剂盒,从起点来说有目的,所以微泡的问题就自动被过滤掉了。我要教大家的就是化繁为简的思路,凋亡小体、微泡、外泌体这三类常见的胞外囊泡的知识是要知道的,但具体做囊泡介导的细胞间通讯,你的选择很简单:做外泌体。因为它包含的内容物和信号分子最丰富,这是当前研究主流。
- 早在1986年,外泌体就被发现了,最初是在绵羊红细胞的培养上清中找到的有磷脂膜结构的小囊泡,后续20年里,其他类型的细胞,主要是免疫细胞都发现了有功能性的外泌体,但真正得到大家关注还是在2007年,发现在肿瘤细胞和正常细胞外泌体之间的差异,其中携带的RNA可实现跨细胞的调控性事件,这在肿瘤微环境研究中是个突破性的证据。2015年,利用转基因小鼠模型,研究人员证实外泌体作为细胞通讯的载体具有广泛性,能够在全身水平上被其他细胞摄取并发挥调控功能。广泛性的证明非常重要,非编码RNA里的miRNA、lncRNA、circRNA都是因为被发现广泛存在引起研究热潮。
- 当前还有把外泌体中特异性表达的分子当作液态活检Biomarker的研究,还有把外泌体当作载药系统和靶向递送系统的研究。凋亡小体包含的是大量降解的核酸碎片、肽段和脂类分子,基本没有用于调控的完整的核酸分子,研究角度有瓶颈。而微泡和外泌体都是可以携带蛋白、脂质和RNA。RNA包括mRNA和非编码RNA,既然所有分子类型里创新最显著的是lncRNA和circRNA,那么加上了外泌体的外衣,这些新颖的非编码RNA分子类型依然要重点关注。
- 追新是科研的一个特点,国内这种追新风气在基金申请的时候表现得尤其突出,但是追新又不能表现得吃相很难看,会显得肤浅。你说你做外泌体circRNA的理由是:“什么新你做什么”,大家心知肚明。但是不要说出来,很尴尬的!要假装是因为前期工作到了这份上,才顺理成章做了这个,用足够的前期工作支撑,这就完美了。
全文总结
- 今天我们重点讲解了在第四层逻辑结构中,担当分子变量的具体类型,主要是循环分子和囊泡+分子。循环分子有DNA,就是cfDNA。肿瘤中有特殊待遇,叫ctDNA。cfRNA也有,但稳定性不高,cf蛋白就是分泌蛋白,以细胞因子为典型,这是老套路。经典是经典,但吸引眼球的效果一般。
- RNA加上囊泡的壳,稳定性的问题就解决了,微泡和外泌体搞清楚外泌体就行了,套路差不多。调控性的RNA加上外泌体,这是囊泡介导的循环分子参与细胞间交互作用最新颖的模式,miRNA+外泌体、lncRNA+外泌体、circRNA+外泌体,值得再进一步的学习和探讨。



