- 高分文章里经常能看到的多元变量构成的分子机制,我们只需要将多元拆分成二元, 间接作用的内容搞清楚上下游,涉及直接作用的,就根据分子类型来确定套用什么模板,见招拆招。
- 在一段时间学习后,如果可以熟练掌握这些模板里包含的数据格式,能够条件反射地预测每一种交互类型会用什么实验来验证,对这些分子交互数据内在的原理和表现形式信手拈来,则你的文献阅读能力将迅速跨入IF=10。在5 分以上的文章里, 直接机制就是大家普遍感觉难以读懂的部分,是造成我们文献理解困难的巨大瓶颈,把这个难关突破了,看懂这些高分文章就没障碍了。
- 至于能不能自己发出来,还取决于我们能不能驾驭这些直接机制研究的实验内容。如果自己临床忙到不能驾驭,可以试试寻求合作伙伴的帮助或者找到外包服务商,把这部分数据实践出来。
复习上一讲中的直接机制类型
根据分子类型进行分类
- 蛋白结合DNA(转录因子)
- 蛋白结合蛋白
- RNA结合RNA(miRNA结合靶基因mRNA的3’-UTR)
- RNA结合蛋白
在非编码RNA出来捣乱之前,蛋白结合蛋白才是直接机制研究的主流模型。研究的人多且流行了多年,已经有非常成熟的研究方法了。
对科研来说,研究方法的成熟度很重要,医生做科研花很多时间在摸索方法上性价比不高,建立原代细胞模型或者新的动物模型都是坑,这些坑折磨过很多医学硕士、博士。再比如LncRNA或者CircRNA研究,确实很新也容易发好文章,但是那是对有实力的课题组而言的,只想两三分的话没有必要一定凑这个热闹,尤其没必要筛选新分子。
如果是一条新的LncRNA,工作还包括了证明这条RNA非编码,常规来说要做一下胞内定位的实验,如果是CircRNA要验证是环状的,在引物设计上跟常规的还有区别。这些细节对于初入科研领域的新手来说都是陷阱, 所以建议在起步阶段大家应该尽量避免。
蛋白结合蛋白的直接机制
- 到了机制这个层面,蛋白的交互对象一般是根据这个蛋白的功能来具体推测,许多潜在的功能可以根据蛋白已知的功能结构域分析出来。蛋白的氨基酸序列会形成空间上的三级结构,这种空间结构对于分子结合显然是必需的。结合不同分子交互对象的结构域都存在某种序列特性,这让研究者可以按图索骥。
- 不少蛋白家族的命名逻辑也是把有类似结构域的蛋白归类到一起,导致我们看名字就容易联想到机制研究的方向。但如果按照蛋白功能来建立互作模型,内容会极度的庞杂,并不推荐这么做。
主变量是蛋白时挖掘直接机制的思路
转录因子
- 如果这个蛋白是转录因子,有已知的DNA结合结构域,那就可以考虑使用蛋白与启动子DNA相互作用的模式,实验设计朝荧光素酶报告基因、ChIP等靠拢。
蛋白-蛋白相互作用
其他
蛋白-蛋白相互作用简介
- Protein-protein Interaction,注意研究领域,和医学/药学领域的质子泵抑制剂(Proton Pump Inhibitor)区分开。
- 蛋白相互作用的定义:2个或以上的,相同的或不同的蛋白形成一个Complex(复合体),执行对应的生物学功能。2 个以上不用怕,也是拆开两两研究。相同的蛋白结合组装叫同源,不同的蛋白组合起来叫异源,二聚体很常见,也可以有三聚体、四聚体等等。
- 这种蛋白装配机制不是我们医学科研主要的研究对象,我们在做机制时候会碰到的主要是 2个不同蛋白的结合。
- 2个不同蛋白结合形成复合物是一种稳定的相互作用,蛋白当然也有瞬时的相互作用,比如酶催化反应就是瞬时的,瞬时的作用是比较弱的相互作用,在蛋白-蛋白互作强度和对科研的贡献上都是如此,酶促反应过程同样不是我们医生常见的研究方向。
- 作为做科研的医生,我们关注的蛋白相互作用是研究目标蛋白与什么蛋白形成稳定的结合,并对介导的功能产生了影响。蛋白结合会影响其功能是大概率事件,只是具体影响了什么功能需要我们去研究。蛋白执行功能的时候单打独斗的是少数,常常是“抱团取暖”,与其他蛋白结合,一起发挥作用。
- 蛋白-蛋白相互作用有着极大的普遍性,你往这个方向做机制基本都能走得通。找蛋白发挥功能的伴侣分子——另一个蛋白,这种经典的套路可以胜任基础科研的各种需求, 值得好好领悟。
- 需要复习伴侣分子的概念的,可以阅读这篇文章
研究蛋白互作的经典实验
质谱(主要用来鉴定)
- 可以复习三十六策 Lesson 7的内容
- 质谱技术的原理相当于查蛋白身份证。每个蛋白都有其唯一的身份证号,可以用质谱来鉴定。质谱一般是送样品去科研平台或技术公司检测,自己做…还是不要了。
co-IP免疫共沉淀(主要用于研究互作)
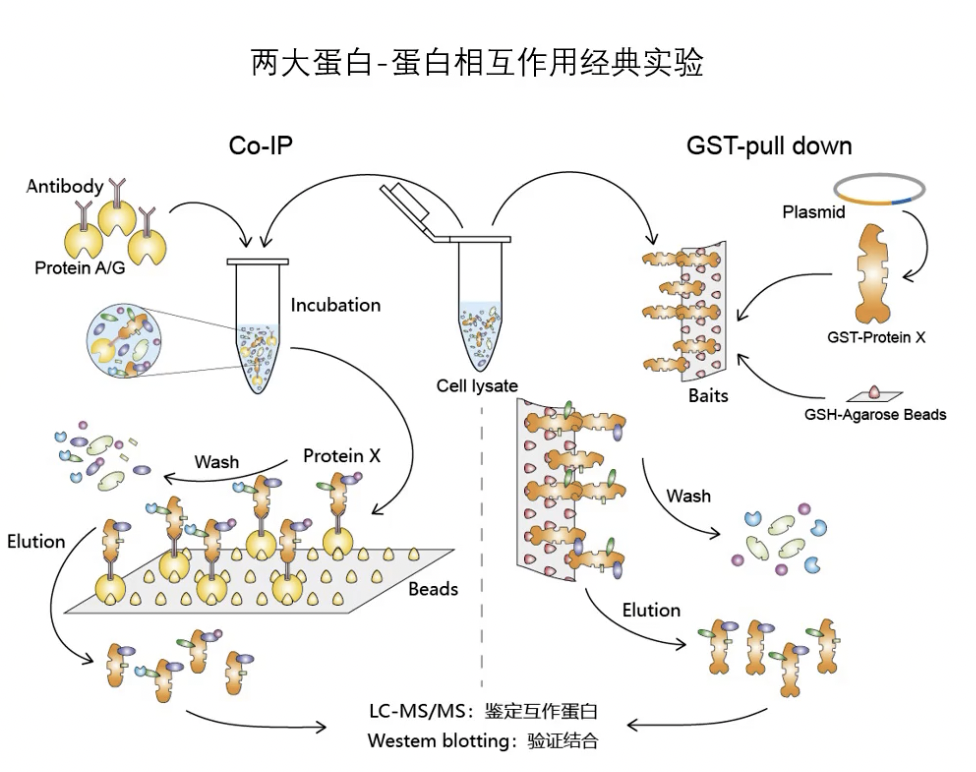
- 复习三十六策 Lesson 16中的染色质免疫共沉淀ChIP技术,后面还会有各种IP,比如RNA结合蛋白的时候还有RIP,即RNA结合蛋白免疫沉淀
先介绍IP
- 免疫沉淀技术immunoprecipitation。免疫指的是抗原抗体相互结合反应,而沉淀是说结合之后把东西富集下来。IP的核心原理是利用特异性的抗体,识别和结合目的蛋白,然后将它富集沉淀。因为同时被富集下来的还有与目的蛋白有结合的其他分子,所以这一步也是研究蛋白互作的必要路径。只要涉及到蛋白跟其他分子结合,无论是DNA、RNA还是蛋白,IP就是最基本的实验手段。
- 抗体属于免疫球蛋白,将抗体用木瓜蛋白酶水解后,可以得到若干片段,其中有一个叫Fc片段。金黄色葡萄球菌中有一种称为protein A的蛋白,它与免疫球蛋白的Fc段有特异性结合的性质,可以用“抗体的抗体”来理解(但不准确,和wb中的二抗完全不是一个东西),跟各种抗体都能结合,具有通用性。我们用Protein A就可以实现把结合了抗体的目的蛋白给拉下来的目的,这样就构成了一个IP体系。protein A结合抗体,抗体再结合靶蛋白。protein A一般买回来就跟琼脂糖珠交联好了,除了protein A常用的还有Protein G,两者在不同物种的抗体上亲和力略有不同,做成珠子比较方便分离,现在更流行用磁珠。
科研品味时间:
珠子英文叫bead,很多珠子加s表复数beads。
基础科研和其他行业一样,为了显示自己的professional, 一些基础科研中的词汇都喜欢用英语。pulldown是因为不好翻译,珠子为什么非要叫beads我也不是很明白,为了跟科学家愉快的交流,这些行话是一定要学和适应的。
琼脂糖珠称作agarose beads,磁珠-magnetic beads,像protein A如果叫蛋白A就透露出一股浓浓的乡土气息。 - 一句话总结,beads买回来就是跟ProteinA是交联好的,beads结合Proterin A,Protein A结合抗体,抗体结合目的蛋白,把目的蛋白沉淀下来,这就是免疫沉淀了。
- 免疫沉淀是一种捕获目的蛋白的方法,还可以用来纯化蛋白。比如Western blot实验里抗体特异性不好,背景噪音很强,就可以在Western之前加一步IP富集,也可以用于阴性富集,把已知的某个杂质蛋白去除。
- 另外比较常见的一种应用是IP拉下来目的蛋白之后去打质谱,这样可以分析蛋白是否有磷酸化、甲基化、糖基化、乙酰化等修饰。这种思路在没有针对修饰的特异性抗体的情况下,也可以检测蛋白修饰。
co-IP
- co-IP多了个co,就变成了共沉淀。co-IP是用IP的原理去富集蛋白复合物,鉴定与研究的靶蛋白存在相互作用的蛋白,是专门用来研究蛋白-蛋白结合的。
- 实验的原理
- 在裂解细胞的时候,我们不把蛋白变性,保留它的天然构象,那么理论上胞内的蛋白-蛋白相互作用就保留了下来。
- 当用固定beads上的protein A去拉免疫沉淀的目标蛋白的时候, 与目标蛋白在体内结合的其他蛋白质也能一起沉淀下来。
- 随后进行变性分离,用另一个蛋白的抗体Western blot检测,就能证实相互作用蛋白了。
- 与IP的区分:IP是把靶蛋白富集沉淀下来,co-IP是检测拉下来的蛋白复合物里面其他结合的蛋白存在。两个实验在目的上就不同。
- co-IP结果表现形式也是Western blot的图,如果我们在文章里看到跟Western差不多的图,但是有IP、IB、input的标注,那就是典型的co-IP结果,说明作者在研究蛋白相互作用,属于直接作用机制的范畴。
- co-IP中若干概念的解释
- Input:一个成功的co-IP实验需要证明靶蛋白和预测存在相互作用的蛋白都存在于免疫沉淀后的蛋白样品中,这个沉淀完的蛋白样品就称为Input。
- IP抗体:我们需要证明input 中同时有两个蛋白的存在,用于沉淀靶蛋白的抗体叫IP抗体,也就是说文章里IP后面标的名字,指的就是具体用了什么蛋白抗体包被beads,去拉相互作用蛋白的。
- IB:B-blot,是指用什么抗体去检测沉淀下来的蛋白。
- co-IP实验结果的理解
- co-IP的图会有点绕,因为相当于一个交叉反应,我们需要用A的抗体做IP拉下来沉淀, 然后用B的抗体做Western检测。再反过来,换成B的抗体做IP,用A的抗体做 Western检测,需要来回正反验证。
- A拉B与B拉A,是论证问题的两个不同角度,不能混为一谈。两种不同角度的认识,就是来回双向验证的必要性,一正一反基因操作是这样,co-IP两个蛋白相互拉也是这样,科学研究凡是能双向论证的,总是双向都做才更严谨。
- co-IP实验并不容易驾驭,除了要双向拉,co-IP结果想要可靠,还需要设置几种阴阳对照,比如只加beads加IP抗体的阴性对照,比如用没有特异性结合的IgG来替代IP抗体的阴性对照。也需要设置阳性对照,A抗体做IP拉下来的沉淀,检测B的时候用 A 的抗体做Western检测,证明IP的效果是OK的,这些对照增加了实验结果中分组的复杂性,导致文章里这样的图很难看懂。
- 分子交互实验就是基础研究里比较深的内容,构建知识体系的时候,只需要了解这个实验的原理,清楚它的应用场景,文章里看到了典型结果,看到input、IP、IB马上能条件反射地明白作者论证目的是什么,就可以大胆继续往下走了。Co-IP结果分组再多,典型结果都只有IP抗体拉下来的沉淀物里面用IB抗体检测,出现了目的条带。擒贼先擒王,知道解开谜题的关键线索在哪里,就不用慌看不懂各种分组了。
补充介绍:tag
- 中文意为标签
- Tag在蛋白研究中使用非常广泛,我们学习蛋白互作的时候必须要掌握。Tag指的是过表达蛋白的时候,在载体上目的基因编码区的N-端或者C-端(mRNA的5’-端或3’-端)加上一段氨基酸序列,形成融合蛋白。
- 加上去的这段多肽能产生特征性的标志,凡是带这个标志的就是我们外源表达的蛋白。这段序列一般比较小,所以不会影响目的蛋白的功能,巧妙就巧妙在虽然小,但是能构成表位供特异性的抗体识别。这样就算没有目的基因的抗体,利用标签的抗体也能够将目的蛋白进行纯化和检测。
- 在蛋白互作的研究中,Tag应用的是非常普遍的,IP时用抗Tag的抗体也能够把带标签的蛋白给拉下来。比较常见的标签有His、Flag、HA和Myc四种,His是6个组氨酸组成的,Flag 是8个氨基酸,HA是9个氨基酸,Myc标签是10个氨基酸,都很小。目的蛋白没有好用抗体的时候,用这些标签做个融合蛋白也是一种思路。
- 还有其他一些常用tag,片段更长,带有其他功能的,其中最重要的是GFP,绿色荧光蛋白。这个蛋白还有个升级款eGFP,e-enhanced,也就是增强型绿色荧光蛋白。 绿色荧光蛋白是第一个发现直接能发光的蛋白,最初来源于水母,这一发现获得了2008年的诺贝尔化学奖,此外还有红色荧光、黄色荧光、蓝色荧光的蛋白等等。红和绿叠在一起表现为黄色。
- 如果一个蛋白与另外一个蛋白发生结合,有一个重要的实验结果可以提供佐证,就是研究蛋白共定位,结合的两个蛋白必然物理空间上是接近的。有两种方法可以做共定位,一种是免疫荧光实验,用二抗来携带荧光探针,两个蛋白分别用两种颜色,红绿叠在一起显黄色就证明是共定位了。另外一种就是把两个蛋白分别做成绿和红的两种融合蛋白,然后看胞内表达定位情况。从这里可以看出来荧光蛋白标签的重要性,它主要的应用是示踪,而且是在活细胞内示踪,现在已经发展到用在活体,细胞动物里都可以示踪。
- 像GFP这样的蛋白也被叫做Reporter,中文名报告基因。His、Flag、HA、Myc只是标签,GFP、RFP既是标签也是Reporter,之前我们提到过几次的luciferase荧光素酶,同样属 于 Reporter。这些系统在基础研究中跟指挥交通的红绿灯一样重要,好在前人都已经把方法 体系发展得比较完善了,对我们来说只是一套拿来就用的工具。
- 额外介绍一个tag,GST(谷胱甘肽巯基转移酶),它的特性有很多:
- 能够把融合蛋白变成高度水溶性的蛋白
- 特异性结合谷胱甘肽,方便纯化融合蛋白
- 可以方便地去除融合蛋白中GST融合部分,用位点特异性蛋白酶切除就可以了
- GST本身就是标签,可以用GST特异性抗体来检测
- 我们介绍这个标签是因为探究蛋白-蛋白相互作用的时候,除了 co-IP,另一个经典的实验就是GST pull-down。
pulldown实验(主要用于研究互作)
- 翻译名称比较糟糕,就不要翻译了,非要翻译可以用“融合蛋白沉降实验”这个名称,但是就像几乎没有人会翻译western blot为免疫印迹实验一样,这个译名使用的也非常之少。
- pulldown实验中,最常用的tag是GST,主要利用了GST与底物结合特异性非常高的特点。
- GST pull-down实验先用基因重 组的方法构建一个GST和目的基因的融合蛋白,利用GST融合蛋白与谷胱甘肽的特异性结合, 把它俩制备到固相载体也就是层析柱上,这相当于一个钓鱼竿上挂上了诱饵,在pulldown实验中有个专门的词叫bait。
- 接下来把细胞裂解液通过层析柱,这时相互作用蛋白就能被吸附,然后换个溶液洗脱就得到了互作蛋白。
- pulldown可以用于筛选,洗下来的互作蛋白打质谱鉴定能知 道是什么东西,也可以用于已知的相互作用验证,拉下来之后做Western。pulldown实验结果在文章里出现的时候也是 western图,以细胞裂解液作为input,单纯GST没有融合目的基因的作为阴性对照,以GST融合蛋白作为 bait,以相互作用蛋白的特异性抗体作为blot检测的抗体,能产生杂交的阳性信号就说明有相互作用。
其他
- 酵母双杂交Y2H
- 噬菌体展示Phage display
- 表面等离子共振SPR
- 荧光共振能量转移FRET
- 蛋白芯片
- …
总结
- co-IP是形成Protein A beads+靶蛋白抗体+靶蛋白+结合蛋白的免疫共沉淀复合物,再以SDS-PAGE胶分离蛋白,用 Western blot进行蛋白检测。当我们不知道结合蛋白是什么的时候,就把IP沉淀下来的复合物送去质谱鉴定,通常我们称作 IP-质谱。分析结果回来,对于可能结合的蛋白进行验证,需要设计正反双向拉的两个co-IP实验。
- pull-down是将目的蛋白固定在一种基质材料上,当细胞裂解液经过该基质的时候,与固定在载体上的蛋白发生相互作用的蛋白被吸附,而没有被吸附的杂质洗脱流出,(相当于层析技术),结合的蛋白后面用溶液再洗下来就可以Western检测了。pull-down也可以用在体外寻找可能与目的蛋白有相互作用的靶蛋白,洗脱完一样是后面接质谱鉴定。
文章里筛选互作蛋白的质谱结果并不是那么重要,也就是筛选过程可以不展示,关键是筛到了什么,以及最后相互作用验证成功没有。
- 筛选之后一定有很多蛋白,全部买抗体很贵,这时候可以先用外源性co-IP验证一轮。外源性co-IP是把目的基因用一个标签,比如His tag构建融合表达载体,然后候选的几个结合蛋 白都用另外一个标签,比如Flag也构建成融合表达载体,一起转染一个工具细胞,然后用标签抗体His和Flag来互拉。这样可以用标签抗体完成全部候选蛋白验证,很方便也很便宜。
- 外源co-IP,因为两个蛋白都是外源导入细胞的,信号会比较强。这一步验证成功后,再去订购特异性抗体,做内源的co-IP。内源验证是在靶细胞里用目的蛋白的抗体和候选结合蛋白的抗体进行互拉。在co-IP沉淀的复合物里,我们只能用 western证明有结合蛋白存在, 不能证明是否直接结合,也可能是通过第三者蛋白介导,所以比较严谨的话,还要做一个 GST-pulldown证明是直接相互作用。pulldown 是用bait来钓鱼,跟co-IP共孵育不一样,没有形成多蛋白复合物的充分条件,pulldown能结合上那就说明是直接结合。再加上前面说的荧光共定位结果,一套高端大气上档次的蛋白-蛋白相互作用机制数据就算出炉了。
- co-IP和pulldown是金标准,其他实验为辅助手段,至于锦上添花要添哪些大家可以根据情况自由发挥。
蛋白-蛋白-DNA的三元交互体系
- 在三十六策 Lesson 19中,我们讨论过,转录调节过程中不仅有直接跟DNA结合的蛋白,还有一些转录的辅助因子, 它们不直接结合DNA,但是却可以结合转录因子,同样产生转录调控的作用,可以促进转录,也可以抑制转录。
- 探究这种转录辅助蛋白功能的实验设计,做Gain of function和Loss of function跟转录因子没差别,都是上调下调看表型变化。做二元变量的调控关系和Rescue也是一样,操作上游观察下游靶基因,以及同时操作主变量和下游靶基因观察表型回复。但是到了研究直接机制的时候,差异就显示出来了。转录辅助因子没有DNA binding domain, 因此它直接结合的对象是转录因子,是蛋白。严格意义上说,它的靶基因并不是下游受到转录调节的那个,而是有蛋白-蛋白相互作用的转录因子。那么验证转录辅助因子与转录因子结合的一套标准动作,就是我们今天讲的 co-IP,GST-pulldown 这些内容。
- 注意,不是做完了蛋白相互作用,这个直接机制研究就结束了。 因为目标分子结合的对象是转录因子,我们关注这种结合有什么功能的时候,自然而然会考虑是不是影响了转录因子对于靶基因的调控,这就从二元关系,延伸成了三元关系。而且,在回答两个蛋白结合对于蛋白结合启动子DNA调节转录 活性有什么影响的时候,还需要有Luciferase+ChIP或者EMSA实验这套标准数据。
补充:预测蛋白交互的数据库
- STRING数据库(见后)
在分子交互的研究中,数据库能起到的作用是有限的,重点还在于基于实验的筛选和验证。
蛋白交互作用研究的文章里很少会看到数据库预测,常规都是做基于实验的筛选和验证,这和miRNA研究找靶基因几乎是100%会去做预测不太一样。co-IP和pulldown都是验证蛋白互作的关键实验,先把这两个实验做熟了,再把拉下来的样品送去打质谱,直接根据质谱回来的结果进一步验证就可以了,习惯上是这么做。


